EUROESCORE: http://www.euroscore.org/
UKPDS: http://www.dtu.ox.ac.uk/riskengine/
SYNTAX: http://www.syntaxscore.com/
FRAMINGHAM: http://www.framinghamheartstudy.org/
REGICOR: http://www.regicor.org/
jueves, 29 de marzo de 2012
DISFUNCION ENDOTELIAL - ESTRATIFICACION DE RIESGO EN SCA; SCORES
Las afecciones cardiovasculares constituyen la
principal causa de muerte en el mundo. Afectan principalmente a personas
jóvenes, económicamente activas, lo que genera un gran impacto a nivel
socioeconómico y un aumento considerable de los costos en salud
pública. El estrés y los malos hábitos higiénico-dietéticos son, en
parte, responsables de esta situación.
Conocer sus diferentes formas de presentación y el mecanismo por el cual se instala la enfermedad cardiovascular es de gran utilidad para lograr prevenirla. Una vez instalada, nos brinda las herramientas para lograr arribar a un diagnóstico y tratamiento precoz.
La compleja red de interacciones biológicas y las consecuencias orgánicas del desequilibrio ponen a la luz los beneficios reales de nuestras intervenciones médicas. El endotelio vascular es un órgano verdadero dentro de otros órganos. Pesa casi 3,5 kilogramos, el 5% del peso corporal total en un adulto de setenta kilogramos, y tiene una longitud de cincuenta micrómetros y un ancho promedio de diez micrómetros. Sus células consumen gran cantidad de energía debido a su activo metabolismo. Ejerce gran cantidad de funciones. Es el encargado de la hemostasis y homeostasis vascular, regula la vasodilatación, la inflamación y la proliferación celular, además de modular el equilibrio entre la trombosis y la fibrinólisis. Constituye una verdadera barrera selectiva que separa y regula el intercambio entre las células sanguíneas y el resto de los tejidos.
La disfunción endotelial es considerada como el primer paso en la evolución de la arteriosclerosis. Esta disfunción se caracteriza principalmente por una reducción en la biodisponibilidad de óxido nítrico e implica la presencia de anormalidades en la integridad del endotelio y en la homeostasis vascular. Todos los factores de riesgo están asociados con la disfunción del endotelio a través del estrés oxidativo directo o indirecto. La oxidación de lipoproteínas de baja densidad y el eje renina-angiotensina-aldosterona juegan un rol importante en su patogenia.
A través de la disfunción del endotelio se genera un aumento en el pasaje de lipoproteínas de baja densidad unidas a lípidos hacia el subendotelio y se inicia un proceso inflamatorio que culmina con la formación de la placa de ateroma. Todo el proceso se desarrolla en medio de un estado sistémico protrombótico. Estas condiciones conducen al accidente de placa, situación que constituye la génesis principal de la cardiopatía isquémica.
El interés científico acerca de la forma de inicio de la enfermedad aterosclerótica y del papel que juegan los principales factores intervinientes condujeron a la realización de este trabajo de revisión para comprender de qué manera y por qué motivo se termina por quebrar este equilibrio fisiológico.
El objetivo de esta revisión es exponer los mecanismos biomoleculares por los cuales la disfunción endotelial es considerada como el principal desorden orgánico que lleva paulatinamente a la formación de la placa de ateroma y a su posterior disrupción y trombogénesis, todos ellos mecanismos que conducen a la obstrucción parcial o total de la luz vascular, con la consecuente isquemia y necrosis tisular.
Desarrollo
Conocer sus diferentes formas de presentación y el mecanismo por el cual se instala la enfermedad cardiovascular es de gran utilidad para lograr prevenirla. Una vez instalada, nos brinda las herramientas para lograr arribar a un diagnóstico y tratamiento precoz.
La compleja red de interacciones biológicas y las consecuencias orgánicas del desequilibrio ponen a la luz los beneficios reales de nuestras intervenciones médicas. El endotelio vascular es un órgano verdadero dentro de otros órganos. Pesa casi 3,5 kilogramos, el 5% del peso corporal total en un adulto de setenta kilogramos, y tiene una longitud de cincuenta micrómetros y un ancho promedio de diez micrómetros. Sus células consumen gran cantidad de energía debido a su activo metabolismo. Ejerce gran cantidad de funciones. Es el encargado de la hemostasis y homeostasis vascular, regula la vasodilatación, la inflamación y la proliferación celular, además de modular el equilibrio entre la trombosis y la fibrinólisis. Constituye una verdadera barrera selectiva que separa y regula el intercambio entre las células sanguíneas y el resto de los tejidos.
La disfunción endotelial es considerada como el primer paso en la evolución de la arteriosclerosis. Esta disfunción se caracteriza principalmente por una reducción en la biodisponibilidad de óxido nítrico e implica la presencia de anormalidades en la integridad del endotelio y en la homeostasis vascular. Todos los factores de riesgo están asociados con la disfunción del endotelio a través del estrés oxidativo directo o indirecto. La oxidación de lipoproteínas de baja densidad y el eje renina-angiotensina-aldosterona juegan un rol importante en su patogenia.
A través de la disfunción del endotelio se genera un aumento en el pasaje de lipoproteínas de baja densidad unidas a lípidos hacia el subendotelio y se inicia un proceso inflamatorio que culmina con la formación de la placa de ateroma. Todo el proceso se desarrolla en medio de un estado sistémico protrombótico. Estas condiciones conducen al accidente de placa, situación que constituye la génesis principal de la cardiopatía isquémica.
El interés científico acerca de la forma de inicio de la enfermedad aterosclerótica y del papel que juegan los principales factores intervinientes condujeron a la realización de este trabajo de revisión para comprender de qué manera y por qué motivo se termina por quebrar este equilibrio fisiológico.
El objetivo de esta revisión es exponer los mecanismos biomoleculares por los cuales la disfunción endotelial es considerada como el principal desorden orgánico que lleva paulatinamente a la formación de la placa de ateroma y a su posterior disrupción y trombogénesis, todos ellos mecanismos que conducen a la obstrucción parcial o total de la luz vascular, con la consecuente isquemia y necrosis tisular.
Desarrollo
El proceso aterosclerótico se inicia en la vida
intrauterina y permanece asintomático hasta los cuarenta a sesenta años
de edad. En más de la mitad de los casos, se manifiesta como un evento
isquémico agudo.
La formación de la estría grasa (antecesor de la placa de ateroma) es un proceso dinámico documentado desde la vida fetal, y el hecho de que progrese a menor o mayor velocidad depende casi exclusivamente de los factores de riesgo asociados y del tiempo de exposición a éstos.
Los factores de riesgo son condiciones naturales o hábitos adquiridos que predisponen a este padecimiento. Algunos son no modificables, como la edad, el sexo y los antecedentes hereditarios. Otros son modificables, como la hipercolesterolemia, la hipertensión arterial, la diabetes, el tabaquismo, la obesidad y el sedentarismo.1 Recientemente se han reconocido también como factores riesgo los estados inflamatorios (enfermedades infecciosas), los valores aumentados de proteína C reactiva y la hiperhomocisteinemia.2 La presencia de estos factores de riesgo genera la producción de especies reactivas del oxígeno que reaccionan contra la célula endotelial provocando su disfunción.
Podemos así afirmar que el estrés oxidativo es el nexo que une a los factores de riesgo con la disfunción del endotelio.
Funciones del endotelio
La formación de la estría grasa (antecesor de la placa de ateroma) es un proceso dinámico documentado desde la vida fetal, y el hecho de que progrese a menor o mayor velocidad depende casi exclusivamente de los factores de riesgo asociados y del tiempo de exposición a éstos.
Los factores de riesgo son condiciones naturales o hábitos adquiridos que predisponen a este padecimiento. Algunos son no modificables, como la edad, el sexo y los antecedentes hereditarios. Otros son modificables, como la hipercolesterolemia, la hipertensión arterial, la diabetes, el tabaquismo, la obesidad y el sedentarismo.1 Recientemente se han reconocido también como factores riesgo los estados inflamatorios (enfermedades infecciosas), los valores aumentados de proteína C reactiva y la hiperhomocisteinemia.2 La presencia de estos factores de riesgo genera la producción de especies reactivas del oxígeno que reaccionan contra la célula endotelial provocando su disfunción.
Podemos así afirmar que el estrés oxidativo es el nexo que une a los factores de riesgo con la disfunción del endotelio.
Funciones del endotelio
El endotelio actúa para mantener la homeostasis
vascular a través de múltiples y complejas interacciones celulares.
Específicamente, el endotelio regula el tono vascular balanceando la
producción de vasodilatadores como el óxido nítrico y vasoconstrictores
como la endotelina-1 (Figura 1). El
óxido nítrico es sintetizado a partir del sustrato L-arginina y actúa
sobre sus diversos órganos efectores, como el músculo liso vascular,
provocando su relajación; el músculo cardíaco, en el que también provoca
su relajación; las plaquetas, sobre las que tiene un efecto
antiadhesivo; y sobre el mismo endotelio, provocando relajación de su
citoesqueleto y aumento de la función de impermeabilidad selectiva. Por
el contrario, la endotelina-1 es considerada en la actualidad como el
vasoconstrictor más potente de la economía. Otra acción del endotelio es
controlar el flujo sanguíneo y la coagulación a través de factores que
regulan la actividad plaquetaria, la cascada de la coagulación y el
sistema fibrinolítico (Figura 2).
También produce prostaciclinas antiagregantes y genera una acción
fibrinolítica relacionada con la síntesis y secreción del activador del
plasminógeno tisular, que cataliza la formación de plasmina, una
sustancia que evita la formación del trombo definitivo por inhibición de
la acción de la fibrina. Tiene la capacidad de producir citoquinas y
moléculas de adhesión que regulan y dirigen el proceso inflamatorio,3 participando en la función de defensa del organismo a través de la activación de neutrófilos y macrófagos.

Figura 1. Regulación del tono vascular mediante el equilibrio entre los factores vasoconstrictores y vasodilatadores del endotelio. ADPasa: adenosín difosfatasa. FHDE: factor hiperpolarizante derivado del endotelio. FAP: factor activador de plaquetas. TXA2: tromboxano A2. Fuente: Braunwald E, Zipes D, Libby P. Braunwald´s Cardiología. 6a. ed. Marbán Libros, 2004, p. 2588.

Figura 2. Equilibrio entre las
propiedades antitrombóticas y protrombóticas del endotelio vascular. En
general, las propiedades antitrombóticas dominan el endotelio intacto
bajo condiciones fisiológicas normales. Por el contrario, las
propiedades protrombóticas se expresan siempre que se activa o se altera
el endotelio. GAG: glucosaminoglucanos. AT III: antitrombina III. IVFT: inhibidor de la vía del factor tisular. ATP-u: activador tisular del plasminógeno tipo uroquinasa. IAP: inhibidor de la activación del plasminógeno. IFAT: inhibidor de la fibrinólisis activable por la trombina. FvW: factor de von Willebrand. FAP:
factor activador de las plaquetas. Fuente: Braunwald E, Zipes D, Libby
P. Braunwald´s Cardiología. 6a. ed. Marbán Libros, 2004, p. 2588.
Todos los estadios en el proceso aterosclerótico están
caracterizados por la presencia de cambios funcionales y morfológicos en
el endotelio conocidos como disfunción endotelial (Figura 3).
Es el estado más representativo de los cambios iniciales de la
aterogénesis. Representa un término colectivo que incluye una serie de
cambios que el endotelio desarrolla durante el proceso aterogénico,
entre los cuales se encuentra la pérdida de las propiedades
anticoagulantes, un incremento en las expresión de moléculas de adhesión
y un incremento del tono vascular como consecuencia de la disminución
en la biodisponibilidad del óxido nítrico.5

Figura 3. Eventos iniciales en la
evolución de la estría grasa. Los monocitos se adhieren al endotelio que
está inducido a expresar moléculas de adhesión como consecuencia del
estímulo inflamatorio. Los monocitos adheridos migran al subendotelio y
se diferencian a macrófagos. Al endocitar oxLDL vía receptores scavenger
(carroñeros) se tranforman en células espumosas. Fuente: Van Haelst PL,
Ziijstra F, May JF. Mechanisms and correlates of inflammation in
atherosclerosis. Introduction and aims of the thesis. 2002, p.16.
El endotelio, en estas condiciones, se torna mucho más permeable al paso de macromoléculas como las LDL-colesterol.
Muchos genes fueron identificados como susceptibles a las variaciones del flujo sanguíneo, como aquel que codifica para el factor de crecimiento derivado de las plaquetas, el activador tisular del plasminógeno y las moléculas de adhesión ICAM-1 y VCAM-1. Las formas oxidadas modificadas de las LDL-colesterol son identificadas también como unas de las principales inductoras de la disfunción endotelial. Inducen cambios fenotípicos en las células del endotelio, que comienzan a expresar moléculas de adhesión facilitando la adhesión de monocitos y linfocitos al endotelio, los que comienzan a sintetizar y liberar quimioquinas para atraer al resto de las células inflamatorias circulantes.5
Cuando el endotelio se encuentra disfuncionante, se genera un medio proaterogénico donde media la inflamación, la proliferación celular y la trombosis. A nivel del endotelio se comienzan a expresar moléculas de adhesión como las selectinas, y las ya mencionadas moléculas de adhesión vascular celular (V-CAM) e intercelular (I-CAM). Se inicia la síntesis y liberación de citoquinas inflamatorias y proteínas quimiotácticas, que tienen como finalidad reclutar células inflamatorias, principalmente monocitos y linfocitos T.
Los monocitos que se encuentran en el subendotelio se activan y transforman en macrófagos que retroalimentan el proceso estimulando la migración de un número mayor de monocitos. Mientras tanto, las células de la capa muscular lisa se modulan a secretoras y comienzan a sintetizar matriz colágena, que más tarde constituirá la capa fibrosa de la placa.
Tanto los clásicos como los nuevos factores de riesgo estimulan la generación de especies reactivas del oxígeno que conducen al estrés oxidativo.
De manera directa o indirecta a través de las proteínas de shock térmico-60 (heat shock protein-60/ HSP-60) se bloquea al inhibidor del factor nuclear kappa-beta (I-κβ) lo que permite su replicación. El factor nuclear kappa-beta (NF-κβ) es un factor de transcripción que regula la expresión de varios genes que se relacionan con el proceso inflamatorio, como el factor de necrosis tumoral alfa (TNF-α), las interleuquinas 1 y 6, moléculas de adhesión y citoquinas, inhibiéndose la acción de la óxido nítrico sintetasa constitutiva endotelial (eNOS) con la consecuente disminución en la síntesis y biodisponibilidad del óxido nítrico, lo cual altera el equilibrio homeostático a favor de las sustancias vasoconstrictoras, proaterogénicas y protrombóticas como la angiotensina II (ATII). A su vez, varias de las citoquinas inflamatorias promueven la síntesis del NF-κβ retroalimentándose el proceso inflamatorio.
Los múltiples factores de riesgo generan estrés oxidativo y por este mecanismo conducen a la disfunción del endotelio. En estadios avanzados predominan los mecanismos de vasoconstricción, proliferación celular, inflamación y trombosis.
La disfunción del endotelio no solo contribuye a la instalación de la enfermedad aterosclerótica sino que es la responsable de su progresión y de la desprotección de las placas de alto riesgo que evolucionan a la rotura, de la instalación del trombo obstructivo u oclusivo, y hasta de su posible fibrinólisis.6
Estrés oxidativo
Muchos genes fueron identificados como susceptibles a las variaciones del flujo sanguíneo, como aquel que codifica para el factor de crecimiento derivado de las plaquetas, el activador tisular del plasminógeno y las moléculas de adhesión ICAM-1 y VCAM-1. Las formas oxidadas modificadas de las LDL-colesterol son identificadas también como unas de las principales inductoras de la disfunción endotelial. Inducen cambios fenotípicos en las células del endotelio, que comienzan a expresar moléculas de adhesión facilitando la adhesión de monocitos y linfocitos al endotelio, los que comienzan a sintetizar y liberar quimioquinas para atraer al resto de las células inflamatorias circulantes.5
Cuando el endotelio se encuentra disfuncionante, se genera un medio proaterogénico donde media la inflamación, la proliferación celular y la trombosis. A nivel del endotelio se comienzan a expresar moléculas de adhesión como las selectinas, y las ya mencionadas moléculas de adhesión vascular celular (V-CAM) e intercelular (I-CAM). Se inicia la síntesis y liberación de citoquinas inflamatorias y proteínas quimiotácticas, que tienen como finalidad reclutar células inflamatorias, principalmente monocitos y linfocitos T.
Los monocitos que se encuentran en el subendotelio se activan y transforman en macrófagos que retroalimentan el proceso estimulando la migración de un número mayor de monocitos. Mientras tanto, las células de la capa muscular lisa se modulan a secretoras y comienzan a sintetizar matriz colágena, que más tarde constituirá la capa fibrosa de la placa.
Tanto los clásicos como los nuevos factores de riesgo estimulan la generación de especies reactivas del oxígeno que conducen al estrés oxidativo.
De manera directa o indirecta a través de las proteínas de shock térmico-60 (heat shock protein-60/ HSP-60) se bloquea al inhibidor del factor nuclear kappa-beta (I-κβ) lo que permite su replicación. El factor nuclear kappa-beta (NF-κβ) es un factor de transcripción que regula la expresión de varios genes que se relacionan con el proceso inflamatorio, como el factor de necrosis tumoral alfa (TNF-α), las interleuquinas 1 y 6, moléculas de adhesión y citoquinas, inhibiéndose la acción de la óxido nítrico sintetasa constitutiva endotelial (eNOS) con la consecuente disminución en la síntesis y biodisponibilidad del óxido nítrico, lo cual altera el equilibrio homeostático a favor de las sustancias vasoconstrictoras, proaterogénicas y protrombóticas como la angiotensina II (ATII). A su vez, varias de las citoquinas inflamatorias promueven la síntesis del NF-κβ retroalimentándose el proceso inflamatorio.
Los múltiples factores de riesgo generan estrés oxidativo y por este mecanismo conducen a la disfunción del endotelio. En estadios avanzados predominan los mecanismos de vasoconstricción, proliferación celular, inflamación y trombosis.
La disfunción del endotelio no solo contribuye a la instalación de la enfermedad aterosclerótica sino que es la responsable de su progresión y de la desprotección de las placas de alto riesgo que evolucionan a la rotura, de la instalación del trombo obstructivo u oclusivo, y hasta de su posible fibrinólisis.6
Estrés oxidativo
Los radicales libres son especies químicas que
presentan un electrón suelto o no apareado, lo que los convierte en
especies muy reactivas. Atacan diferentes estructuras produciendo daño a
nivel de las membranas y el citoesqueleto, peroxidación lipídica y daño
directo al ADN.7
El estrés oxidativo no es otra cosa que un disbalance entre las defensas antioxidantes (intrínsecas o extrínsecas) y un exceso en la producción de radicales libres.8,9
Hiperhomocisteinemia
El estrés oxidativo no es otra cosa que un disbalance entre las defensas antioxidantes (intrínsecas o extrínsecas) y un exceso en la producción de radicales libres.8,9
Hiperhomocisteinemia
La homocisteína es un producto normal del metabolismo
de la metionina (aminoácido esencial). Puede ser reciclada a través de
la vía de recuperación de la metionina o de la vía de formación de
cisteína. Este metabolito, en la circulación general y en los tejidos,
por su grupo tiol, tiende a formar puentes disulfuro, tanto entre sus
moléculas como con las de otros compuestos.
Puede considerarse a la homocisteína y los disulfuros que ella forma como pares redox, forma reducida-homocisteína, formas oxidadas-disulfuros (homocistina, homocisteína-cisteína). Además existe una vía alternativa por la cual el óxido nítrico pierde sus propiedades al reaccionar con el grupo sulfhidrilo de la homocisteína para formar S-nitrosohomocisteína.10
En presencia de oxígeno, la homocisteína sufre un proceso de autooxidación con producción de potentes especies reactivas del oxígeno, como el anión superóxido, el peróxido de hidrógeno y el anión hidroxilo. La producción de estos radicales libres se ve directamente beneficiada ante los valores patológicamente aumentados de homocisteína (hiperhomocisteinemia) y pueden provocar oxidación de las lipoproteínas de baja densidad además de daño directo y disfunción del endotelio.11
La alteración de los factores genéticos ven afectada la vía de recuperación de cisteína y metionina a partir de homocisteína por mutación en los genes que codifican para la cistationina beta-sintasa y la metileno tetrahidrofolato reductasa, respectivamente. El tabaquismo, el consumo excesivo de café y la baja ingesta de folato también predisponen directamente al aumento plasmático de homocisteína. Está demostrado que una dieta rica en vegetales, frutas, jugo de naranja y cereales está asociada a bajos niveles de homocisteína y altos de ácido fólico.
El ácido fólico y la vitamina B12 son indispensables para la remetilación de homocisteína nuevamente a metionina. La deficiencia subclínica de estas vitaminas puede aumentar la homocisteína plasmática a través de la disminución de la remetilación.12
La exposición prolongada del endotelio a la homocisteína puede generar disminución en la biodisponibilidad del óxido nítrico por dos vías: la primera consiste en la afectación de su síntesis de manera directa o mediada por especies reactivas del oxígeno o por productos resultantes de la peroxidación lipídica. La segunda resulta del agotamiento del gas ya formado al aumentar la posibilidad de formar S-nitrosohomocisteína13 generándose un circulo vicioso que agrava aún más el daño oxidativo y bloquea el efecto vasodilatador y antiaterogénico del óxido nítrico.
Como se mencionó anteriormente, la hiperhomocisteinemia genera un aumento significativo en la producción de anión superóxido. Este radical libre interfiere en forma activa en la biodisponibilidad del óxido nítrico, reacciona con él para formar peroxinitrito (ONOO–) un potente oxidante que puede nitrar las proteínas y generar gran daño celular además de generar disminución en las concentraciones efectivas del óxido nítrico.14
Ungvari y cols.15 demostraron recientemente que la hiperhomociteinemia aumenta la generación de anión superóxido a nivel de las coronarias. Este proceso se llevaría a cabo a través de una vía indirecta donde la homocisteína estimula la expresión del factor de necrosis tumoral alfa que, a su vez, puede aumentar la actividad y expresión vascular de la enzima nicotinamida adenina dinuclétido fosfato oxidasa (NADPH oxidasa) la que resulta ser una fuente importante de anión superóxido.
Además, el factor de necrosis tumoral alfa (TNF-α) es una citoquina que a nivel subendotelial participa en el crecimiento celular y de la matriz extracelular y activa otras citoquinas proinflamatorias (Figura 4).
Puede considerarse a la homocisteína y los disulfuros que ella forma como pares redox, forma reducida-homocisteína, formas oxidadas-disulfuros (homocistina, homocisteína-cisteína). Además existe una vía alternativa por la cual el óxido nítrico pierde sus propiedades al reaccionar con el grupo sulfhidrilo de la homocisteína para formar S-nitrosohomocisteína.10
En presencia de oxígeno, la homocisteína sufre un proceso de autooxidación con producción de potentes especies reactivas del oxígeno, como el anión superóxido, el peróxido de hidrógeno y el anión hidroxilo. La producción de estos radicales libres se ve directamente beneficiada ante los valores patológicamente aumentados de homocisteína (hiperhomocisteinemia) y pueden provocar oxidación de las lipoproteínas de baja densidad además de daño directo y disfunción del endotelio.11
La alteración de los factores genéticos ven afectada la vía de recuperación de cisteína y metionina a partir de homocisteína por mutación en los genes que codifican para la cistationina beta-sintasa y la metileno tetrahidrofolato reductasa, respectivamente. El tabaquismo, el consumo excesivo de café y la baja ingesta de folato también predisponen directamente al aumento plasmático de homocisteína. Está demostrado que una dieta rica en vegetales, frutas, jugo de naranja y cereales está asociada a bajos niveles de homocisteína y altos de ácido fólico.
El ácido fólico y la vitamina B12 son indispensables para la remetilación de homocisteína nuevamente a metionina. La deficiencia subclínica de estas vitaminas puede aumentar la homocisteína plasmática a través de la disminución de la remetilación.12
La exposición prolongada del endotelio a la homocisteína puede generar disminución en la biodisponibilidad del óxido nítrico por dos vías: la primera consiste en la afectación de su síntesis de manera directa o mediada por especies reactivas del oxígeno o por productos resultantes de la peroxidación lipídica. La segunda resulta del agotamiento del gas ya formado al aumentar la posibilidad de formar S-nitrosohomocisteína13 generándose un circulo vicioso que agrava aún más el daño oxidativo y bloquea el efecto vasodilatador y antiaterogénico del óxido nítrico.
Como se mencionó anteriormente, la hiperhomocisteinemia genera un aumento significativo en la producción de anión superóxido. Este radical libre interfiere en forma activa en la biodisponibilidad del óxido nítrico, reacciona con él para formar peroxinitrito (ONOO–) un potente oxidante que puede nitrar las proteínas y generar gran daño celular además de generar disminución en las concentraciones efectivas del óxido nítrico.14
Ungvari y cols.15 demostraron recientemente que la hiperhomociteinemia aumenta la generación de anión superóxido a nivel de las coronarias. Este proceso se llevaría a cabo a través de una vía indirecta donde la homocisteína estimula la expresión del factor de necrosis tumoral alfa que, a su vez, puede aumentar la actividad y expresión vascular de la enzima nicotinamida adenina dinuclétido fosfato oxidasa (NADPH oxidasa) la que resulta ser una fuente importante de anión superóxido.
Además, el factor de necrosis tumoral alfa (TNF-α) es una citoquina que a nivel subendotelial participa en el crecimiento celular y de la matriz extracelular y activa otras citoquinas proinflamatorias (Figura 4).

Figura 4. Los niveles aumentados de
homocisteína estimulan la expresión del factor de necrosis tumoral
alfa. Esta citoquina activa la NADPH oxidasa, que a su vez genera
grandes cantidades de superóxido (O2–), pero también estimula la producción de óxido nítrico a través de la óxido sintetasa inducible (iNOS). El O2– interactúa con el óxido nítrico y lleva así a la formación peroxinitrito (ONOO–)
con lo que se reduce la biodisponibilidad de óxido nítrico. La
consecuencia de este proceso es la disfunción endotelial. Por vías
separadas el TNF-α aumenta la expresión de otras citoquinas
proinflamatorias y moléculas de crecimiento. En conjunto, estos
mecanismos producen aterosclerosis y trombosis. Fuente: Dr. Ferreira
Ricardo. Hiperhomocisteinemia: nuevos avances en la patogénesis y
resultados de los últimos estudios clínicos, 2003.
Otro punto a tener en cuenta es la acción de la
homocisteína sobre la actividad plaquetaria y la coagulación. En este
sentido, la homocisteína puede alterar la trombosis normal y retardar o
interferir con el proceso de cicatrización de la herida, al alterar la
interacción de la fibronectina con la fibrina, paso fundamental para la
formación del trombo definitivo.16 Por otro lado, la acción
procoagulante de esta molécula se manifiesta con el aumento de forma
indirecta de la activación del factor 5 procoagulante endotelial e
inactivando a la proteína C (una sustancia anticoagulante) y a la
trombomodulina. Cabe destacar que concentraciones fisiológicas de
homocisteína promueven la unión de lipoproteína A a la fibrina,
inhibiendo de esta manera la activación del plasminógeno y por ende la
fibrinólisis. Además, in vitro promueve la adhesión de plaquetas y monocitos a las células endoteliales (Tabla 1).

Por todo lo expuesto, y en base a estudios
epidemiológicos poblacionales, se consideraba a la hiperhomocisteinemia
como un factor de riesgo cardiovascular independiente ya que predispone a
la aterogénesis a través del estrés oxidativo y genera un estado
protrombótico que predispone al accidente de placa.
En el año 2006, el estudio multicéntrico, aleatorizado, doble ciego, controlado con placebo HOPE-2 17 evaluó si el tratamiento con ácido fólico combinado con vitaminas B6 y B12 reducía el riesgo de eventos vasculares mayores en individuos con alto riesgo cardiovascular. Fueron 5.522 pacientes en su mayoría hombres con una media de 55 años y antecedentes de enfermedad vascular o diabetes asignados aleatoriamente a recibir la combinación de ácido fólico más vitamina B6 y B12 vs. placebo, con un seguimiento a cinco años. El end point primario evaluó el combinado de muerte cardiovascular, infarto de miocardio (IAM) o accidente cerebrovascular (ACV) y el secundario los eventos isquémicos totales, la mortalidad global, la internación por angina inestable e insuficiencia cardíaca y la incidencia de cáncer y muerte por cáncer. Se detectaron niveles más bajos de homocisteína en el grupo que recibía tratamiento activo. El estudio no demostró ser significativo para ambos end points (Tabla 2).
En el año 2006, el estudio multicéntrico, aleatorizado, doble ciego, controlado con placebo HOPE-2 17 evaluó si el tratamiento con ácido fólico combinado con vitaminas B6 y B12 reducía el riesgo de eventos vasculares mayores en individuos con alto riesgo cardiovascular. Fueron 5.522 pacientes en su mayoría hombres con una media de 55 años y antecedentes de enfermedad vascular o diabetes asignados aleatoriamente a recibir la combinación de ácido fólico más vitamina B6 y B12 vs. placebo, con un seguimiento a cinco años. El end point primario evaluó el combinado de muerte cardiovascular, infarto de miocardio (IAM) o accidente cerebrovascular (ACV) y el secundario los eventos isquémicos totales, la mortalidad global, la internación por angina inestable e insuficiencia cardíaca y la incidencia de cáncer y muerte por cáncer. Se detectaron niveles más bajos de homocisteína en el grupo que recibía tratamiento activo. El estudio no demostró ser significativo para ambos end points (Tabla 2).

En el análisis de subgrupos, se evidenció una
significativa menor incidencia de ACV en el grupo tratado activamente
(4,0% vs. 5,3%; p=0,03) y mayor incidencia de internaciones por angina
inestable comparados con los asignados a placebo (9,7% vs. 7,9%;
p=0,03). Este estudio concluye que el suplemento de ácido fólico y
vitaminas del grupo B en pacientes con enfermedad vascular no reduce el
riesgo de presentar eventos cardiovasculares mayores, si bien se asocia
con una reducción en los niveles plasmáticos de homocisteína. El
incremento en el riesgo de internación por angina inestable no es
consistente y podría estar relacionado con dificultades en el
diagnóstico o incluso debido al azar. Del mismo modo, debe interpretarse
cuidadosamente la reducción en la incidencia de ACV ya que los eventos
fueron pocos en número y en la reducción del riesgo se utilizaron
amplios intervalos de confianza.
En el mismo año, el estudio NORVIT,18 en pacientes con infarto agudo de miocardio reciente (dentro de los 7 días), y el VISP (año 2005),19 en enfermos con ACV isquémico, tampoco demostraron disminuir la incidencia de eventos mayores en pacientes tratados con esta combinación.
Analizando los puntos expuestos, es correcto interpretar que la homocisteinemia más que un predictor independiente de mortalidad cardiovascular constituye un marcador temprano de vasculopatía. Esto se desprende a raíz de que los pacientes portadores de enfermedad vascular presentan niveles aumentados de homocisteína en sangre pero la reducción de estos valores no tiene ningún impacto sobre la morbimortalidad ni sobre las internaciones de causa vascular.
Aldosterona
En el mismo año, el estudio NORVIT,18 en pacientes con infarto agudo de miocardio reciente (dentro de los 7 días), y el VISP (año 2005),19 en enfermos con ACV isquémico, tampoco demostraron disminuir la incidencia de eventos mayores en pacientes tratados con esta combinación.
Analizando los puntos expuestos, es correcto interpretar que la homocisteinemia más que un predictor independiente de mortalidad cardiovascular constituye un marcador temprano de vasculopatía. Esto se desprende a raíz de que los pacientes portadores de enfermedad vascular presentan niveles aumentados de homocisteína en sangre pero la reducción de estos valores no tiene ningún impacto sobre la morbimortalidad ni sobre las internaciones de causa vascular.
Aldosterona
La corteza suprarrenal produce hormonas
mineralocorticoideas y glucocorticoideas. Dentro de las primeras, la
principal es la aldosterona, que actúa principalmente a nivel del túbulo
renal colector reteniendo agua y sodio y excretando potasio. Además,
tiene acción sobre otras estructuras como el miocardio y el endotelio.
Los mayores reguladores de la secreción de aldosterona son la angiotensina II, el potasio y la ACTH.
Esta hormona posee la capacidad de inducir o inhibir la síntesis de proteínas y de colágeno por los fibroblastos, y puede generar fibrosis intersticial reactiva a nivel del miocardio, principalmente en pacientes con gran activación del eje renina-angiotensina-aldosterona como consecuencia de la evolución natural de la insuficiencia cardíaca.
La aldosterona provoca disfunción endotelial, principalmente al aumentar la biodisponibilidad de NADPH, generando aumento en la producción de especies reactivas del oxígeno con el consecuente daño directo del endotelio por estrés oxidativo. Por otro lado, induce inflamación vascular, aumenta la síntesis de colágeno por los fibroblastos, estimula la apoptosis e inhibe o disminuye la producción de óxido nítrico, estimula al gen que codifica para las ICAM-1, favoreciendo así la adhesión de leucocitos al endotelio20 (Figura 5).
Los mayores reguladores de la secreción de aldosterona son la angiotensina II, el potasio y la ACTH.
Esta hormona posee la capacidad de inducir o inhibir la síntesis de proteínas y de colágeno por los fibroblastos, y puede generar fibrosis intersticial reactiva a nivel del miocardio, principalmente en pacientes con gran activación del eje renina-angiotensina-aldosterona como consecuencia de la evolución natural de la insuficiencia cardíaca.
La aldosterona provoca disfunción endotelial, principalmente al aumentar la biodisponibilidad de NADPH, generando aumento en la producción de especies reactivas del oxígeno con el consecuente daño directo del endotelio por estrés oxidativo. Por otro lado, induce inflamación vascular, aumenta la síntesis de colágeno por los fibroblastos, estimula la apoptosis e inhibe o disminuye la producción de óxido nítrico, estimula al gen que codifica para las ICAM-1, favoreciendo así la adhesión de leucocitos al endotelio20 (Figura 5).

Figura 5. Efectos perjudiciales de la aldosterona. Fuente: Dr. De la Serna Fernando, Insuficiencia cardíaca crónica, 2007, p. 68.
A diferencia de lo que ocurre con la homocisteína, el
bloqueo de los receptores de mineralocorticoides sí demostró reducir la
incidencia de eventos mayores.
El estudio RALES, en el año 1999,21 asignó en forma aleatoria pacientes portadores de insuficiencia cardíaca crónica en clase funcional III-IV (de la NYHA) con fracción de eyección ventricular menor o igual al 35%, que recibían tratamiento óptimo, a recibir diferentes dosis de espironolactona vs. placebo. Este estudio evidenció una reducción significativa de la mortalidad y morbilidad en pacientes portadores de insuficiencia cardíaca severa tratados con dosis habituales de fármacos.
El estudio EPHESUS, en el año 2003,22 aleatorizó un número mayor de pacientes con IAM (entre 3 y 14 días del evento), fracción de eyección menor del 40% y clínica de insuficiencia cardíaca (no excluyente para los pacientes diabéticos) a recibir placebo o eplerenona. Demostró una reducción de la mortalidad de causa cardíaca a expensas de la reducción de la muerte súbita y una significativa disminución en el número de internaciones por insuficiencia cardíaca (Figuras 6 y 7).
El estudio RALES, en el año 1999,21 asignó en forma aleatoria pacientes portadores de insuficiencia cardíaca crónica en clase funcional III-IV (de la NYHA) con fracción de eyección ventricular menor o igual al 35%, que recibían tratamiento óptimo, a recibir diferentes dosis de espironolactona vs. placebo. Este estudio evidenció una reducción significativa de la mortalidad y morbilidad en pacientes portadores de insuficiencia cardíaca severa tratados con dosis habituales de fármacos.
El estudio EPHESUS, en el año 2003,22 aleatorizó un número mayor de pacientes con IAM (entre 3 y 14 días del evento), fracción de eyección menor del 40% y clínica de insuficiencia cardíaca (no excluyente para los pacientes diabéticos) a recibir placebo o eplerenona. Demostró una reducción de la mortalidad de causa cardíaca a expensas de la reducción de la muerte súbita y una significativa disminución en el número de internaciones por insuficiencia cardíaca (Figuras 6 y 7).

Figura 6. Curvas de Kaplan-Meier
correspondientes a la muerte por cualquier causa en el ensayo EPHESUS.
Fuente: Revista Española de Cardiología suplemento 2006; 6: 48B-58B.

Figura 7. Curvas de Kaplan-Meier
correspondientes a la muerte súbita a los 30 días en el ensayo EPHESUS.
Fuente: Revista Española de Cardiología suplemento 2006; 6: 48B-58B.
Varios son los mecanismos que pueden estar involucrados
en estos efectos. Los bloqueantes de los receptores de
mineralocorticoides evitan el remodelado ventricular inadecuado, reducen
la síntesis de colágeno cicatrizal, limitan la inflamación vascular
coronaria e inhiben la actividad simpática.23
Óxido nítrico
Síntesis
Óxido nítrico
Síntesis
Es un gas que se libera por la conversión del
aminoácido L-arginina en L-citrulina; se requiere además la presencia de
calmodulina y 4 cofactores más: flavín mononuclétido (FMN), flavín
adenina dinuclétido (FAD), tetrahidrobiopterina (THB) y nicotinamida
adenina dinucleótido fosfato (NADPH). Dicha reacción es catalizada por
la enzima óxido nítrico sintetasa (NOS), que puede ser inhibida por
derivados de similar estructura.
En presencia de calmodulina, los electrones donados por el NADPH son transportados por el FAD y por FMN hacia el grupo hemo de la NOS, así la L-arginina se convierte en N-hidroxialanina y luego en NO y L-citrulina (Figura 8).
En presencia de calmodulina, los electrones donados por el NADPH son transportados por el FAD y por FMN hacia el grupo hemo de la NOS, así la L-arginina se convierte en N-hidroxialanina y luego en NO y L-citrulina (Figura 8).

Figura 8. Fuente: Mondaca D. Higes EA. Importancia clínica del óxido nítrico en el sistema cardiovascular. Madrid, 1992.
La tetrahidrobiopterina (también llamada sapropterina o
BH4) es un cofactor esencial de las tres hidroxilasas de aminoácidos
aromáticos: la fenilalanina-4-hidroxilasa (para la conversión de
fenilalanina a tirosina), la tirosina-3-hidroxilasa (para la conversión
de tirosina a L-dopa), y la triptófano-5-hidroxilasa (para la conversión
de triptófano a 5-hidroxitriptófano). También es esencial para la
síntesis de óxido nítrico mediante la óxido nítrico sintetasa.
El óxido nítrico, gracias a su bajo peso molecular y capacidad de difusión, atraviesa la íntima endotelial hasta llegar a la capa muscular lisa. Una vez allí, a través de la nitrosilación del hemo de la enzima guanilil ciclasa, degrada el guanosina trifosfato cíclico (GTP) y así libera guanosina monofosfato (GMP), con reducción de la concentración de calcio citosólico y provocando relajación de la fibra muscular lisa con la consecuente vasodilatación. Cuando cesa el efecto del óxido nítrico, una fosfodiesterasa recicla el GTP a partir del GMP y así cesa la vasodilatación.
Se conoce más de una forma de NOS. Dos isoformas constitutivas calcio dependientes (cNOS) son la endotelial (eNOS) o tipo III y la neural (nNOS) o tipo I, que están presentes en diferentes tejidos como endotelio, neuronas y neuroglia y producen concentraciones fisiológicas de este gas por períodos breves cuando son estimuladas por sustancias vasodilatadoras como acetilcolina, bradiquinina o sustancia P. Otra, calcio independiente (INOS) o tipo II, es inducible en un número de tipos celulares como macrófagos, músculo liso y endotelio, y producen óxido nítrico en forma sostenida en respuesta a diferentes estímulos inmunológicos derivados del interferón gamma, el factor de necrosis tumoral alfa y el liposacárido bacteriano. Se produce así gran cantidad de óxido nítrico que puede llegar a ser tóxico para células tumorales o parasitadas por virus. Tanto la NOS III (calcio dependiente) como la NOS II (calcio independiente) coexisten en la célula endotelial.
Presión de cizallamiento o “shear stress”
El óxido nítrico, gracias a su bajo peso molecular y capacidad de difusión, atraviesa la íntima endotelial hasta llegar a la capa muscular lisa. Una vez allí, a través de la nitrosilación del hemo de la enzima guanilil ciclasa, degrada el guanosina trifosfato cíclico (GTP) y así libera guanosina monofosfato (GMP), con reducción de la concentración de calcio citosólico y provocando relajación de la fibra muscular lisa con la consecuente vasodilatación. Cuando cesa el efecto del óxido nítrico, una fosfodiesterasa recicla el GTP a partir del GMP y así cesa la vasodilatación.
Se conoce más de una forma de NOS. Dos isoformas constitutivas calcio dependientes (cNOS) son la endotelial (eNOS) o tipo III y la neural (nNOS) o tipo I, que están presentes en diferentes tejidos como endotelio, neuronas y neuroglia y producen concentraciones fisiológicas de este gas por períodos breves cuando son estimuladas por sustancias vasodilatadoras como acetilcolina, bradiquinina o sustancia P. Otra, calcio independiente (INOS) o tipo II, es inducible en un número de tipos celulares como macrófagos, músculo liso y endotelio, y producen óxido nítrico en forma sostenida en respuesta a diferentes estímulos inmunológicos derivados del interferón gamma, el factor de necrosis tumoral alfa y el liposacárido bacteriano. Se produce así gran cantidad de óxido nítrico que puede llegar a ser tóxico para células tumorales o parasitadas por virus. Tanto la NOS III (calcio dependiente) como la NOS II (calcio independiente) coexisten en la célula endotelial.
Presión de cizallamiento o “shear stress”
El estímulo físico principal que estimula la liberación
de óxido nítrico es la presión de rozamiento o fuerza tangencial sobre
la pared del vaso, conocido como “shear stress”, que se genera por el
aumento del flujo dentro de la arteria y que conduce a la
vasodilatación. Su magnitud es directamente proporcional a la cantidad
de óxido nítrico liberado por el endotelio. Esta presión genera un gran
rango de efectos en la expresión de diferentes genes en las células
endoteliales. Las proteínas que codifican de esos genes juegan roles
importantes en la regulación de la función endotelial mediante procesos
fisiológicos y patológicos como la proliferación celular, la
vasodilatación, la vasoconstricción y la respuesta inflamatoria.24
Este mecanismo se hallaría alterado en pacientes hipertensos e hipercolesterolémicos debido a una disminución en la bioactividad del óxido nítrico, disminuyendo la respuesta al aumento del flujo sanguíneo. Así se desarrollan y mantienen resistencias vasculares periféricas elevadas en personas que padecen de hipertensión.25 Paradójicamente, en pacientes con hipercolesterolemia y biodisponibilidad disminuida de óxido nítrico la dilatación vascular se mantiene. Esta situación particular es atribuible a otros factores vasoactivos endoteliales.26
Buse y cols. sugieren que a nivel de los vasos sanguíneos existe un factor físico que activa a los mecanorreceptores de la pared vascular, induciendo la síntesis de óxido nítrico. Demostraron además que el óxido nítrico liberado podría actuar de forma local en el músculo liso, con una vida media muy corta, de escasos segundos.27
El shear stress es un estímulo protector que evita la formación y el accidente de la placa de colesterol mediante la liberación de óxido nítrico. Los niveles fisiológicos de shear stress son de 6 a 70 dinas/cm2.28 Menos de 6 dinas/cm2 se reduce la liberación de óxido nítrico y la balanza del equilibrio endotelial se inclina hacia la génesis de una atmósfera proinflamatoria; por el contrario, valores superiores a las 70 dinas/cm2 podrían generar daño endotelial con exposición del subendotelio, agregación plaquetaria y trombosis.
Óxido nítrico y actividad plaquetaria
Este mecanismo se hallaría alterado en pacientes hipertensos e hipercolesterolémicos debido a una disminución en la bioactividad del óxido nítrico, disminuyendo la respuesta al aumento del flujo sanguíneo. Así se desarrollan y mantienen resistencias vasculares periféricas elevadas en personas que padecen de hipertensión.25 Paradójicamente, en pacientes con hipercolesterolemia y biodisponibilidad disminuida de óxido nítrico la dilatación vascular se mantiene. Esta situación particular es atribuible a otros factores vasoactivos endoteliales.26
Buse y cols. sugieren que a nivel de los vasos sanguíneos existe un factor físico que activa a los mecanorreceptores de la pared vascular, induciendo la síntesis de óxido nítrico. Demostraron además que el óxido nítrico liberado podría actuar de forma local en el músculo liso, con una vida media muy corta, de escasos segundos.27
El shear stress es un estímulo protector que evita la formación y el accidente de la placa de colesterol mediante la liberación de óxido nítrico. Los niveles fisiológicos de shear stress son de 6 a 70 dinas/cm2.28 Menos de 6 dinas/cm2 se reduce la liberación de óxido nítrico y la balanza del equilibrio endotelial se inclina hacia la génesis de una atmósfera proinflamatoria; por el contrario, valores superiores a las 70 dinas/cm2 podrían generar daño endotelial con exposición del subendotelio, agregación plaquetaria y trombosis.
Óxido nítrico y actividad plaquetaria
Las plaquetas poseen la capacidad de generar óxido
nítrico mediante la presencia de una eNOS vía el GMPc. El estímulo para
la liberación se inicia durante la agregación y adhesión de la plaqueta
al endotelio vascular y la cantidad de óxido nítrico generado está en
relación con la magnitud de la activación plaquetaria.
El óxido nítrico inhibe la adhesión e induce la desagregación plaquetaria. De esta manera se produce un equilibrio regulando la actividad plaquetaria.
La disfunción del endotelio puede conducir a la adhesión de plaquetas y leucocitos y producir hiperplasia de la íntima vascular. Al adherirse las plaquetas a estos sitios disfuncionales se produce contracción del músculo liso vascular por acción del tromboxano A2 y la serotonina (liberados por las plaquetas) y se estimula la proliferación y migración de las células musculares lisas por acción del factor de crecimiento derivado de plaquetas (PDGF). Por el contrario, el óxido nítrico y las prostaciclinas inhiben la adhesión plaquetaria y de glóbulos blancos, el crecimiento, la proliferación y migración celular.
El GMPc inhibe la fosfolipasa C y A2 en las plaquetas, lo que regula la función de algunos receptores de plaquetas tales como el receptor del fibrinógeno IIb/IIIa y P-selectinas.25
Inflamación y aterotrombosis
El óxido nítrico inhibe la adhesión e induce la desagregación plaquetaria. De esta manera se produce un equilibrio regulando la actividad plaquetaria.
La disfunción del endotelio puede conducir a la adhesión de plaquetas y leucocitos y producir hiperplasia de la íntima vascular. Al adherirse las plaquetas a estos sitios disfuncionales se produce contracción del músculo liso vascular por acción del tromboxano A2 y la serotonina (liberados por las plaquetas) y se estimula la proliferación y migración de las células musculares lisas por acción del factor de crecimiento derivado de plaquetas (PDGF). Por el contrario, el óxido nítrico y las prostaciclinas inhiben la adhesión plaquetaria y de glóbulos blancos, el crecimiento, la proliferación y migración celular.
El GMPc inhibe la fosfolipasa C y A2 en las plaquetas, lo que regula la función de algunos receptores de plaquetas tales como el receptor del fibrinógeno IIb/IIIa y P-selectinas.25
Inflamación y aterotrombosis
Todo se inicia en los lugares donde el endotelio
comienza a presentar moléculas de adhesión, en particular las VCAM-1,
que ligan a los linfocitos T y monocitos. Al principio, estas células
ruedan, se adhieren al endotelio y finalmente penetran al subendotelio
atraídas por las citoquinas inflamatorias. La proteína quimiotáctica de
monocitos es la encargada de la atracción y migración de los monocitos a
los sitios donde se esta desarrollando la placa de ateroma.
Los glóbulos blancos que participan del proceso inflamatorio no solo forman parte de él sino que perpetúan estos mecanismos a través de la liberación de sustancias que lo retroalimentan.
Los macrófagos activados comienzan a liberar proteínas líticas de matriz conocidas como metaloproteinasas matriciales (MMP), que son las encargadas de degradar la fina capa fibrosa que cubre y envuelve la placa de ateroma volviéndola susceptible a la rotura. Son las células musculares lisas las que migran alrededor del núcleo lipídico y se modulan a secretoras. Una vez reubicadas, comienzan a sintetizar matriz extracelular que conformará la cubierta fibrosa de la placa.
En contraparte, los linfocitos T comienzan a liberar interferón gamma, que inhibe la producción y liberación de colágeno matricial y estimula a los macrófagos que comienzan a liberar enzimas líticas. De esta manera se limita severamente la capacidad de renovación de la capa fibrosa y aumenta severamente el riesgo de accidentarse.
Todas las células intervinientes, contenidas en el interior de la placa, tienen la capacidad de producir factor tisular.
El factor tisular es el componente principal que detonará la cascada de la coagulación en el momento del evento de placa, convirtiéndose en uno de los factores primordiales de la trombogénesis.
Cabe destacar que los mediadores inflamatorios modulan la expresión del factor tisular por parte de los macrófagos activados, demostrándose una relación más que comprobable entre inflamación y trombosis.29
La presencia de los marcadores serológicos de la inflamación tales como la PCR, la interleuquina -6, la sustancia amiloide sérica A, la ICAM-1 soluble y el CD40 ligando se correlaciona con un pronóstico adverso. Queda así demostrada la colaboración del proceso inflamatorio en lograr la inestabilidad de la placa aterosclerótica.
Recordemos que no solo los monocitos participan de este proceso. También forman parte de la placa los infiltrados de linfocitos T (CD4+) Th, llamados helpers (ayuda), y los linfocitos T (CD8+). Este fenómeno pone al descubierto la existencia de una respuesta inmunológica celular específica.
Por un lado, la actividad de los linfocitos T (CD4+) Th1 producen sustancias inflamatorias que activan de manera significativa el proceso inflamatorio (TNF-α, interleuquina-2) y por otro la respuesta celular de los linfocitos T (CD4+) Th2 es protectora, liberando sustancias que inhiben decididamente la acción de las sustancias proinflamatorias (interleuquinas 4, 5, 10, y 13).30
Dependiendo del tipo de respuesta inmunológica, la balanza se inclinará hacia la progresión o regresión de la placa de colesterol.
De la génesis de la placa al paciente vulnerable
Los glóbulos blancos que participan del proceso inflamatorio no solo forman parte de él sino que perpetúan estos mecanismos a través de la liberación de sustancias que lo retroalimentan.
Los macrófagos activados comienzan a liberar proteínas líticas de matriz conocidas como metaloproteinasas matriciales (MMP), que son las encargadas de degradar la fina capa fibrosa que cubre y envuelve la placa de ateroma volviéndola susceptible a la rotura. Son las células musculares lisas las que migran alrededor del núcleo lipídico y se modulan a secretoras. Una vez reubicadas, comienzan a sintetizar matriz extracelular que conformará la cubierta fibrosa de la placa.
En contraparte, los linfocitos T comienzan a liberar interferón gamma, que inhibe la producción y liberación de colágeno matricial y estimula a los macrófagos que comienzan a liberar enzimas líticas. De esta manera se limita severamente la capacidad de renovación de la capa fibrosa y aumenta severamente el riesgo de accidentarse.
Todas las células intervinientes, contenidas en el interior de la placa, tienen la capacidad de producir factor tisular.
El factor tisular es el componente principal que detonará la cascada de la coagulación en el momento del evento de placa, convirtiéndose en uno de los factores primordiales de la trombogénesis.
Cabe destacar que los mediadores inflamatorios modulan la expresión del factor tisular por parte de los macrófagos activados, demostrándose una relación más que comprobable entre inflamación y trombosis.29
La presencia de los marcadores serológicos de la inflamación tales como la PCR, la interleuquina -6, la sustancia amiloide sérica A, la ICAM-1 soluble y el CD40 ligando se correlaciona con un pronóstico adverso. Queda así demostrada la colaboración del proceso inflamatorio en lograr la inestabilidad de la placa aterosclerótica.
Recordemos que no solo los monocitos participan de este proceso. También forman parte de la placa los infiltrados de linfocitos T (CD4+) Th, llamados helpers (ayuda), y los linfocitos T (CD8+). Este fenómeno pone al descubierto la existencia de una respuesta inmunológica celular específica.
Por un lado, la actividad de los linfocitos T (CD4+) Th1 producen sustancias inflamatorias que activan de manera significativa el proceso inflamatorio (TNF-α, interleuquina-2) y por otro la respuesta celular de los linfocitos T (CD4+) Th2 es protectora, liberando sustancias que inhiben decididamente la acción de las sustancias proinflamatorias (interleuquinas 4, 5, 10, y 13).30
Dependiendo del tipo de respuesta inmunológica, la balanza se inclinará hacia la progresión o regresión de la placa de colesterol.
De la génesis de la placa al paciente vulnerable
Para definir este concepto es necesario destacar
aspectos importantes que se desarrollaron a lo largo de este trabajo de
investigación. Cabe destacar, además, la importancia de los factores de
riesgo como escenario predisponente y como gatillo inicial de la
fisiopatología del IAM.
Los factores de riesgo (clásicos y nuevos) generan disfunción endotelial, tanto sea por un mecanismo directo como indirecto. En estas condiciones aumenta la permeabilidad del endotelio para el pasaje de lipoproteínas de baja densidad cargadas de colesterol (LDL-c) y comienzan a desarrollarse una serie de eventos relacionados con mecanismos que inician y perpetúan la reacción inflamatoria. Comienza la migración celular, donde linfocitos T y monocitos se adhieren a proteínas de adhesión del tipo de las V-CAM. Atraídos por factores quimiotácticos específicos atraviesan el endotelio por un mecanismo de diapédesis y se internan en el subendotelio. Una vez allí, los monocitos se activan y se convierten en macrófagos. Por medio de receptores carronieros comienzan a fagocitar LDL oxidadas y detritus celulares. A medida que el macrófago se carga de lípidos se conforma la célula espumosa que mantiene el proceso inflamatorio liberando sustancias quimiotácticas y activadoras. Por otro lado el linfocito T modula la respuesta celular especifica según sea perfil Th1 o Th2 (en mas o en menos respectivamente).
En este contexto las células musculares lisas responden a las señales quimiotácticas, abandonan su sitio original, bordean al núcleo lipídico y se modifican a secretoras. Comienzan a liberar sustancias que formaran parte de la matriz extracelular para conformar lo que será la cubierta fibrosa de la placa.
El crecimiento excesivo del núcleo lipídico que genera necrosis de la placa, el contenido lipídico mayor al 40%, la gran concentración de factor tisular, la fina cubierta fibrosa y el tamaño reducido de la placa (que no llega a obstruir mas del 50% de la luz del vaso) la convierten en vulnerable a la rotura.
Todos los acontecimientos se desarrollan en presencia de factores de riesgo como el LDL-c, el tabaquismo y la diabetes. Se suman los niveles aumentados de factor tisular circulante, cuyas fuentes principales son: los restos de macrófagos apoptóticos, las microparticulas de placas ateroscleroticas y fundamentalmente, los macrófagos activados. Esto genera un estado procoagulante y protrombótico que aumenta las chances de generar un evento agudo de placa. Todas estas características son las que definen al paciente vulnerable.
Este estado de vulnerabilidad sumado a la presencia de placas con alto riesgo de rotura definen al paciente de alto riesgo.
El paciente de alto riesgo es aquel que por su condición clínica posee un riesgo aumentado de sufrir un evento agudo de placa comparado con la población general.
Seguido a la disrupción de la capa fibrosa se produce liberación de factor tisular, exposición del endotelio, activación plaquetaria, vasoconstricción y formación de trombo oclusivo parcial o total. La disminución parcial o brusca del flujo sanguíneo genera isquemia de los tejidos. De perpetuarse, la injuria se torna irreversible, el tejido se infarta y es reemplazado más tarde por tejido fibroso cicatrizal.
Discusión
Los factores de riesgo (clásicos y nuevos) generan disfunción endotelial, tanto sea por un mecanismo directo como indirecto. En estas condiciones aumenta la permeabilidad del endotelio para el pasaje de lipoproteínas de baja densidad cargadas de colesterol (LDL-c) y comienzan a desarrollarse una serie de eventos relacionados con mecanismos que inician y perpetúan la reacción inflamatoria. Comienza la migración celular, donde linfocitos T y monocitos se adhieren a proteínas de adhesión del tipo de las V-CAM. Atraídos por factores quimiotácticos específicos atraviesan el endotelio por un mecanismo de diapédesis y se internan en el subendotelio. Una vez allí, los monocitos se activan y se convierten en macrófagos. Por medio de receptores carronieros comienzan a fagocitar LDL oxidadas y detritus celulares. A medida que el macrófago se carga de lípidos se conforma la célula espumosa que mantiene el proceso inflamatorio liberando sustancias quimiotácticas y activadoras. Por otro lado el linfocito T modula la respuesta celular especifica según sea perfil Th1 o Th2 (en mas o en menos respectivamente).
En este contexto las células musculares lisas responden a las señales quimiotácticas, abandonan su sitio original, bordean al núcleo lipídico y se modifican a secretoras. Comienzan a liberar sustancias que formaran parte de la matriz extracelular para conformar lo que será la cubierta fibrosa de la placa.
El crecimiento excesivo del núcleo lipídico que genera necrosis de la placa, el contenido lipídico mayor al 40%, la gran concentración de factor tisular, la fina cubierta fibrosa y el tamaño reducido de la placa (que no llega a obstruir mas del 50% de la luz del vaso) la convierten en vulnerable a la rotura.
Todos los acontecimientos se desarrollan en presencia de factores de riesgo como el LDL-c, el tabaquismo y la diabetes. Se suman los niveles aumentados de factor tisular circulante, cuyas fuentes principales son: los restos de macrófagos apoptóticos, las microparticulas de placas ateroscleroticas y fundamentalmente, los macrófagos activados. Esto genera un estado procoagulante y protrombótico que aumenta las chances de generar un evento agudo de placa. Todas estas características son las que definen al paciente vulnerable.
Este estado de vulnerabilidad sumado a la presencia de placas con alto riesgo de rotura definen al paciente de alto riesgo.
El paciente de alto riesgo es aquel que por su condición clínica posee un riesgo aumentado de sufrir un evento agudo de placa comparado con la población general.
Seguido a la disrupción de la capa fibrosa se produce liberación de factor tisular, exposición del endotelio, activación plaquetaria, vasoconstricción y formación de trombo oclusivo parcial o total. La disminución parcial o brusca del flujo sanguíneo genera isquemia de los tejidos. De perpetuarse, la injuria se torna irreversible, el tejido se infarta y es reemplazado más tarde por tejido fibroso cicatrizal.
Discusión
La etiología de la enfermedad vascular ha sido objeto
de intenso estudio en la última década. El aumento de la incidencia a
nivel mundial y el impacto socioeconómico y en salud pública son en
parte responsables de este fenómeno. La presencia de los factores de
riesgo, en su mayoría modificables, relaciona directamente a los malos
estilos de vida con la enfermedad aterosclerótica.
Reconocer los mecanismos biomoleculares intervinientes durante el proceso de la enfermedad nos brinda el conocimiento científico para lograr comprender e interpretar la compleja red de interacciones que se plantean entre el endotelio vascular y las diferentes noxas.
El endotelio, además de responder a diferentes estímulos del medio, tiene la capacidad intrínseca de liberar independientemente sustancias agónicas y antagónicas con el fin de mantener el equilibrio necesario para que las diferentes funciones vitales sean llevadas a cabo con normalidad.
Los factores de riesgo producen estrés oxidativo, que altera la capacidad de la célula endotelial de mantener la homeostasis vascular y se produce lo que se conoce como disfunción endotelial.
La disfunción endotelial genera un medio óptimo para la instalación y desarrollo de la enfermedad aterosclerótica.
Múltiples son los intentos de mantener el equilibrio que lleva a cabo el endotelio una vez activado.
La exposición prolongada a las sustancias nocivas presentes en el plasma y la acción directa de los diferentes factores de riesgo terminan por agotar la capacidad moduladora del endotelio.
La presencia de los diferentes marcadores de enfermedad vascular y el antagonismo ejercido por diferentes fármacos hace de los tratamientos una manera de restituir la integridad del endotelio. Más útil es aún la acción destinada a cambiar los malos hábitos por estilos de vida más saludable para evitar la instalación y progresión de la enfermedad vascular.
Los resultados antagónicos de los estudios HOPE-2, NORVIT y VISP vs. RALES y EPHESUS en comprobar la disminución de eventos mayores mediante la reducción o el bloqueo de sustancias lesivas para el endotelio pone de manifiesto la intrincada red de sucesos agónicos, antagónicos y de escape que resta aún por dilucidar.
Actualmente se cuenta con suficientes comprobaciones vinculadas a la disfunción endotelial como para asumir que su evaluación tiene valor diagnóstico y significación pronóstica a largo plazo.1
Conclusión
Reconocer los mecanismos biomoleculares intervinientes durante el proceso de la enfermedad nos brinda el conocimiento científico para lograr comprender e interpretar la compleja red de interacciones que se plantean entre el endotelio vascular y las diferentes noxas.
El endotelio, además de responder a diferentes estímulos del medio, tiene la capacidad intrínseca de liberar independientemente sustancias agónicas y antagónicas con el fin de mantener el equilibrio necesario para que las diferentes funciones vitales sean llevadas a cabo con normalidad.
Los factores de riesgo producen estrés oxidativo, que altera la capacidad de la célula endotelial de mantener la homeostasis vascular y se produce lo que se conoce como disfunción endotelial.
La disfunción endotelial genera un medio óptimo para la instalación y desarrollo de la enfermedad aterosclerótica.
Múltiples son los intentos de mantener el equilibrio que lleva a cabo el endotelio una vez activado.
La exposición prolongada a las sustancias nocivas presentes en el plasma y la acción directa de los diferentes factores de riesgo terminan por agotar la capacidad moduladora del endotelio.
La presencia de los diferentes marcadores de enfermedad vascular y el antagonismo ejercido por diferentes fármacos hace de los tratamientos una manera de restituir la integridad del endotelio. Más útil es aún la acción destinada a cambiar los malos hábitos por estilos de vida más saludable para evitar la instalación y progresión de la enfermedad vascular.
Los resultados antagónicos de los estudios HOPE-2, NORVIT y VISP vs. RALES y EPHESUS en comprobar la disminución de eventos mayores mediante la reducción o el bloqueo de sustancias lesivas para el endotelio pone de manifiesto la intrincada red de sucesos agónicos, antagónicos y de escape que resta aún por dilucidar.
Actualmente se cuenta con suficientes comprobaciones vinculadas a la disfunción endotelial como para asumir que su evaluación tiene valor diagnóstico y significación pronóstica a largo plazo.1
Conclusión
La enfermedad cardiovascular debe ser considerada como
un síndrome clínico donde participan diferentes elementos todos unidos a
través de complejas interacciones biológicas.
La presencia de los diferente factores de riesgo generan daño endotelial directo e indirecto. El intento del endotelio activado por mantener la homeostasis vascular se ve amputado por la presencia prolongada de las diferentes sustancias intervinientes, generándose el medio propicio para la instalación y progresión de la enfermedad vascular.
Conocer los aspectos biológicos y moleculares de la enfermedad aterosclerótica permite interpretar con solidez científica los diferentes procesos que se presentan durante el proceso de la enfermedad, además de conocer los verdaderos beneficios de nuestras intervenciones médicas.
La presencia de los diferente factores de riesgo generan daño endotelial directo e indirecto. El intento del endotelio activado por mantener la homeostasis vascular se ve amputado por la presencia prolongada de las diferentes sustancias intervinientes, generándose el medio propicio para la instalación y progresión de la enfermedad vascular.
Conocer los aspectos biológicos y moleculares de la enfermedad aterosclerótica permite interpretar con solidez científica los diferentes procesos que se presentan durante el proceso de la enfermedad, además de conocer los verdaderos beneficios de nuestras intervenciones médicas.
GRACE; http://www.outcomes-umassmed.org/grace/acs_risk/acs_risk_content.html
http://www.outcomes-umassmed.org/grace/
TIMI; http://www.timi.org/
CRUSADE: http://www.crusadebleedingscore.org/
;
CARDIOTOXICIDAD
EFECTOS ADVERSOS POR ESTATINAS
Efectos adversos a nivel muscular
Detección y prevención de problemas musculares
En la decisión clínica enfrentamos dos alternativas que pueden implicar peligropara nuestros pacientes:
1) La suspensión innecesaria por sospecha de efectos adversos menores,
privándolos de una medicación de utilidad crítica.
2) Riesgo de inducir una grave toxicidad muscular.
Mialgias
No existe evidencia de que las estatinas causen más debilidad muscular o
mialgias, sobre la base de los ensayos controlados contra placebo. Dado que el tema se ha instalado en la cultura popular, una tarea fundamental del médico tratante es asegurar al paciente que en su inmensa mayoría esos malestares no provienen de las estatinas sino de cualquier otro origen (esfuerzo muscular, osteoartrosis, etc.). En casos dudosos puede hacerse dosaje de CPK y períodos de interrupción.
Niveles de CPK elevados : En los grandes ensayos controlados, la incidencia de elevación de CPK aún 10 veces por encima de lo normal es similar en el grupo placebo y en el grupo tratado con estatinas, salvo cuando las dosis utilizadas son elevadas. No parece justificado controlar la CPK en forma sistemática en ausencia de síntomas, dado que su detección casual puede llevar a la interrupción innecesaria de los fármacos.
Miopatía y rabdomiólisis
Frente a los pacientes con marcada fatiga y malestares musculares, es
conveniente efectuar dosaje de CPK, y si es elevado (más de 10 veces el valor máximo normal), suspender la medicación, en particular si existen factores de riesgo clínicos o medicación concomitante. La incidencia de la forma grave de miopatía, la rabdomiólisis, es de sólo 1 cada decenas de miles de pacientes tratados. Con las medicaciones actuales, la mayoría de los casos se presentan durante el primer o segundo año de tratamiento, y presentan síntomas desde una semana antes de requerir internación.
Problemas musculares y asociación de fármacos
Fibratos
La asociación con fibratos, fenofibrato o gemfibrozil eleva varias veces el riesgode rabdomiólisis pero aún así la incidencia es muy baja comparada con elbeneficio clínico en morbimortalidad que aporta esta asociación en pacientes conhipertrigliceridemia severa y elevación del colesterol. Los pacientes tratadosdeben ser advertidos del riesgo y aconsejados de acudir a la consulta frente aepisodios de fatiga y dolor muscular, para ser controlados con mayor atención.No se justifica tampoco en estos casos el dosaje periódico de CPK, dado que nocontamos con información de su utilidad.
Antibióticos, antimicóticos, cirugías de magnitudLa modificación de la biodisponibilidad de las estatinas con los macrólidos,antimicóticos y otras drogas que actúan sobre el citocromo P 450 hacenpreferible su suspensión transitoria durante el período que se requieran estosfármacos. La suspensión transitoria de las estatinas en pacientescardiológicamente estables no incrementa el riesgo de padecer un síndromecoronario agudo. Cuando la droga a asociar es para uso crónico (digoxina,amiodarona) el control es similar a lo referido con fibratos. No existe riesgo decontinuar con estatinas frente a cirugías generales.
Efectos Adversos a nivel Hepático:
Prevención y detección
Es conveniente efectuar un perfil hepático con dosaje de bilirrubina, fosfatasaalcalina y transaminasas antes del comienzo de estatinas. La presencia dealteraciones menores no es motivo para no comenzar el tratamiento, pero seráde gran utilidad para el control ulterior.
• No existe coincidencia en la periodicidad necesaria del control evolutivo de losniveles enzimáticos, que en la inmensa mayoría de los casos son atribuibles aefecto farmacológico y no a toxicidad. En ensayos de grandes dimensiones sehizo cada 6 a 12 meses.
• Las elevaciones de transaminasas por debajo de 2,5 veces el límite máximonormal (por ejemplo, para el valor habitual en nuestro medio de TGP 40 mg%implicaría superar 100mg%) son muy comunes y no son motivo paramodificar la dosis y menos interrumpir el tratamiento, ni tampoco unimpedimento para elevarla si el control obtenido del colesterol aún no esadecuado. No se correlacionan en las biopsias con daño hepático ni tienenninguna implicancia clínica conocida.
• Las elevaciones mayores deben llevar a la interrupción por un período breve,y explorar la coexistencia de otras explicaciones para el fenómeno (ingesta dealcohol, infecciones virales, etc.). Puede luego recomenzarse controlando si elefecto se reitera, lo que implicará una evaluación más completa de laeventual coexistencia de una hepatopatía.
• La colestasis por estatinas, con elevación de bilirrubina y fosfatasa alcalina esmuy poco frecuente y de fácil detección clínica por la sintomatologíaacompañante (ictericia y prurito) y debe llevar a la suspensión de lamedicación completando el estudio de otra eventual hepatopatía.
• Los especialistas afirman que no existe contraindicación para el uso deestatinas en presencia de hígado graso no alcohólico, cirrosis compensada yotras hepatopatías no graves.Una buena parte de la publicidad adversa a las estatinas en los últimos años hasurgido de la estrategia de marketing del ezetimibe, cuya utilidad comoalternativa de las estatinas o reducción de su dosis no ha sido evaluada enensayos clínicos de grandes dimensiones y resulta cuestionada por los resultadosdel ensayo Enhance.
ANTIINFLAMATORIOS
Toxicidad por inhibidores de la COX 2
Existen evidencias de ensayos clínicos controlados del incremento de eventos cardiovasculares (infarto, ACV) con rofecoxib, valdecoxib y más polémico concelecoxib y lumiracoxib. Este efecto se ha observado con el uso crónico pero yaa partir de los 30 días con la medicación oral, y en horas con el uso intravenosoen el posoperatorio de cirugía cardiovascular. El agregado de aspirina en variosensayos ha neutralizado el efecto protrombótico, pero lleva a la pérdida de laventaja respecto de los AINE tradicionales en la reducción de la hemorragiagastrointestinal. Estudios recientes con etoricoxib han demostrado un perfil deseguridad similar al diclofenac, pero probablemente inferior al naproxeno.AINEs tradicionalesEn los ensayos controlados contra rofecoxib y lumiracoxib, naproxeno hamostrado una menor incidencia de complicaciones cardiovasculares, lo que no seha observado con ibuprofeno o diclofenac. No existen evidencias de ensayoscontrolados de grandes dimensiones sobre el efecto protector o inductor deeventos de estos fármacos, y estudios de cohorte sugieren que se asocian aincremento de riesgo. No reemplazan la acción antiplaquetaria de la aspirina, porlo cual la aspirina no debe suspenderse en pacientes que la requieran enprevención primaria o secundaria cuando se asocia otro AINE.
CARDIOTOXICIDAD POR DROGAS ONCOLÓGICAS
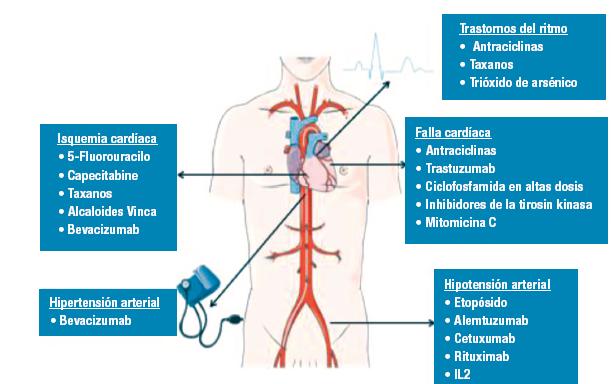
Drogas de uso frecuente en oncología y efectos cardiotóxicos másfrecuentes en la práctica clínica
DROGA EVENTO CARDIACO ADVERSO CARACTERISTICASANTRACICLINAS
- Doxorrubicina (adriamicina)- Epirrubicina Disfunción ventricular izquierda Insuficiencia cardíaca La disfunción puededesarrollarse en forma aguda, subaguda, y con mayor frecuencia luego de años definalizado el tratamiento Depende de la dosis acumulada Mayor riesgo en: Jóvenes / Ancianos Post radioterapia (RT) mediastinal Sexo femenino Historia de enfermedad cardíacaMenor toxicidad:Infusión continua Droga liposomalUso de dexrazoxaneAGENTES ALQUILANTES- Cisplatino- CiclofosfamidaIsquemiaHipertensión arterialInsuficiencia cardíacaPericarditisMiocarditisInsuficiencia cardíacaRiesgo de insuficienciacardíaca mayoren ancianos, postradioterapia torácicao post tratamiento conantraciclinas.Miocarditis hemorrágicacon altas dosis.Insuficiencia cardíaca condosis acumulativaselevadas, ancianos, RTtorácica o posttratamiento conantraciclinas.ANTIMETABOLITOS- Fluorouracilo- CapecitabineIsquemiaRiesgo aumentado enpacientes conenfermedad coronaria, RTtorácica previa, platinoconcurrente.Tasa de infusión y dosisdependiente.Posible mecanismo:vasoespasmo.ANTIMICROTUBULOS- Paclitaxel- Alcaloides dela VincaBradicardia sinusal / bloqueoAV / Taquicardia ventricular /Hipotensión / ICCIsquemiaHipotensión porhipersensibilidad.Insuficiencia cardíacacongestiva cuandose asocia conantraciclinas.Riesgo aumentado enpacientes conenfermedad coronaria oRT torácica previa.AGENTES BIOLÓGICOSAnticuerposmonoclonales-Rituximab-TrastuzumabHipotensión / Angioedema /ArritmiasInsuficiencia cardíacacongestivaDepresión de la FEVI einsuficiencia cardíacaque aparecen durante eltratamiento activo ytienden a disminuirluego. Mejoran con IECA.AGENTES HORMONALES- Tamoxifeno- LetrozoleTVP / Flebitis superficialHipertensión arterialLa TVP es un eventoinfrecuente.Antracíclicos y cardiotoxicidadPrevención de cardiotoxicidada. No superar las siguientes dosisDoxorrubicina-adriamicina 450 – 550 mg/ m2Daunorrubicina 400 – 550 mg/ m2Epirrubicina 650 mg/ m2Mitoxantrona 120 – 140 mg/ m2b. Dexrazosane en pacientes con Ca de mama avanzado que requieren altasdosisMonitoreo y conductas frente a la cardiotoxicidad:a. Previo al comienzo del tratamiento:Medición de la fracción de eyección (FEVI) con ECO ó VTG radioisotópicob. Durante el tratamientoPacientes con función ventricular inicial normalEvaluación reiterada de la función ventricular izquierdaCada tres meses o si se supera 300mg/ m2Criterios de suspensión del fármacoContinuación: si la FEVI no cayó o hasta 10% absoluto y con valoresnormalesSuspensión:a. Caída de la FEVI 10 a 15% (valor absoluto) o 1-5% debajo del límitenormal ób. Caída del 16% como valor absoluto respetando o no el valor límiteinferior.Pacientes con disfunción ventricular inicialElevada probabilidad de efecto cardiotóxicoMedición previa a cada administraciónSuspensión:Caída absoluta de 10% de la FEVIDisfunción ventricular severaNo iniciar tratamiento si la FEVI basal es menor de <30%Cardiotoxicidad Subaguda y alejadaFEVI cada 6 a 12 meses luego de finalizar el tratamiento.Conductas:Si se detecta caída de la FEVI: tratamiento con inhibidores de la ECATrastuzumab y cardiotoxicidadLa cardiotoxicidad asociada al trastuzumab tiene particularidades que ladiferencian de las antraciclinas, lo que tiene gran relevancia clínica:1) Se presenta en la etapa de tratamiento activo, lo que permite su detección através de medidas de evaluación de función ventricular durante el tratamiento, y2) tiene alta probabilidad de ser controlado o revertido con tratamientofarmacológico. Esto contrasta con la cardiotoxicidad por antraciclinas: la mayorparte de los casos se presentan en forma alejada al tratamiento y cuando seasocia a insuficiencia cardíaca clínica es de difícil control terapéutico.Con el advenimiento de nuevas terapias para el manejo de las neoplasias se ha logrado un gran impacto en la sobrevida de los pacientes con cáncer, convirtiendo a esta enfermedad, en muchos casos, en una patología crónica, tal como la diabetes o la hipertensión. Y a su vez, estos avances han generado otros problemas asociados a los efectos adversos de los fármacos utilizados1.
Las complicaciones cardiovasculares son un efecto ampliamente conocido de la quimioterapia desde 1967, cuando se reportaron los primeros casos de falla cardíaca en niños con leucemia que recibían altas dosis de antraciclinas2. La cardiotoxicidad se define según The National Cancer Institute3 como “la toxicidad que afecta al corazón”. Sin embargo, este concepto es muy simple y puede tener muchas interpretaciones por lo que quizás una de las más completas y útiles es la propuesta por los grupos de investigación y supervisión del trastuzumab (anticuerpo monoclonal humanizado IgG1 contra el receptor 2 del factor de crecimiento epidérmico humano -HER2-) los cuales consideran que existe toxicidad cardiovascular si se cumple uno o más de los siguientes criterios (Figura 1)4:
1- Cardiomiopatía con disminución de la fracción de eyección.
2- Presencia de síntomas de falla cardíaca.
3- Presencia de signos de falla cardíaca.
4- Disminución de menos del 5% de la fracción de eyección basal o fracción de eyección del ventrículo izquierdo (FEVI) menor al 55% con síntomas.
5- Disminución de más del 10% de la fracción de eyección basal o FEVI menor al 55% sin síntomas.
Figura 1. Definición de cardiotoxicidad según los criterios del Grupo de Investigación del trastuzumab.
FEVI: fracción de eyección del ventrículo izquierdo.
Los eventos cardiovasculares secundarios al tratamiento oncológico pueden ocurrir días o semanas después del manejo o algunas veces meses o años, luego de terminada la quimioterapia, por lo cual pueden abarcar un amplio espectro de manifestaciones que incluyen: aumento transitorio de las cifras tensionales, arritmias, isquemia miocárdica, insuficiencia cardíaca, vasculopatía periférica y pericardiopatía. Muchas veces estas manifestaciones son confundidas con las secuelas de los tumores, o con los síntomas asociados al cáncer como la fatiga y las comorbilidades previas, ocasionando que en reiteradas ocasiones sean infra-diagnosticadas y por lo tanto sub-tratadas5.
En el pasado, la cardiotoxicidad era percibida como una complicación muy rara y poco importante del manejo antineoplásico. Actualmente, se sabe que las antraciclinas, el 5-fluorouracilo con su prodroga capecitabine y el trastuzumab se asocian con el desarrollo de insuficiencia cardíaca hasta en un 20% de los pacientes que han recibido estos fármacos6.
En esta revisión se resumen los principales síndromes relacionados con la toxicidad cardíaca, su fisiopatología y cómo poder enfocar adecuadamente cada uno con las ayudas diagnósticas y terapéuticas en la actualidad con un enfoque práctico para el clínico.
Principios básicos de quimioterapia para entender la cardiotoxicidad
Los primeros fármacos eficaces contra el cáncer aparecieron a principios de la década de 1940, cuando los marineros de un barco se expusieron accidentalmente a la mostaza nitrogenada. Como resultado de esto, presentaron disminución del conteo leucocitario e hipoplasia del tejido linfoide. Este hallazgo fue utilizado posteriormente por Goodman y Gilman para tratar un hombre con linfoma avanzado con respuesta parcial; de ahí en adelante, han aparecido diversas moléculas que interfieren con la biología de las células tumorales (Figura 2)7.
Figura 2. Diferentes mecanismos de acción de los fármacos utilizados en la quimioterapia.
Para comprender adecuadamente los mecanismos de acción de los antineoplásicos es necesario conocer cómo se desarrolla el cáncer y los factores que contribuyen a ello. En primer lugar, es importante mencionar que las neoplasias se originan de alteraciones de uno o más genes en el organismo, éstas pueden ser hereditarias (que pasan de generación en generación) o adquiridas por el daño del material genético. Hay dos tipos de genes responsables de la aparición de tumores: los oncogenes que al mutar promueven una proliferación no controlada de las células y los genes supresores de tumor que normalmente están encargados de evitar una replicación desmedida de las células; por lo que cualquier daño en éstos llevaría a la aparición de cáncer. La identificación de estas anormalidades abre una puerta para el desarrollo de la terapia genética en un futuro, actualmente no existen medicaciones aprobadas para este uso8.
El cáncer aparece a su vez cuando una célula en particular se escapa de los controles habituales, generando la formación de una descendencia igualmente anormal. Los factores de crecimiento y sus receptores en la membrana son fundamentales para la división celular. Algunos genes pueden afectar directamente este sistema, causando sobreproducción o sobreexpresión de estas moléculas lo cual produce un estímulo constante para la replicación. Existen dos familias de receptores importantes en la oncología: los receptores de estrógenos y los receptores tirosin kinasa. Los primeros son utilizados principalmente en el manejo del cáncer de mama y próstata, pero no es frecuente la cardiotoxicidad, a excepción del tamoxifeno que se ha relacionado con eventos trombóticos como se mencionará posteriormente.
El genoma humano contiene alrededor de 100 genes que codifican tirosin kinasas. Estas son una familia de enzimas cuya función es regular la división celular, la apoptosis y otras múltiples funciones. Hay tres tipos de genes pertenecientes a esta familia que son de particular importancia en el manejo actual del cáncer: el receptor del factor de crecimiento epidérmico (RFCE), el receptor del factor de crecimiento del endotelio vascular (RFCEV) y las tirosin kinasas no dependientes del receptor9.
Los RFCE son una familia que se encuentra normalmente en las células epiteliales cuyos principales miembros son el HER2, HER3, HER4 y el RFCE. Estos están formados por un dominio extracelular en donde se une el factor de crecimiento y un dominio intracelular que posee acción enzimática. Una vez que se unen estas proteínas a su receptor, éste se dimeriza (formación de pares) y se produce la activación bioquímica cuyo resultado final es la proliferación. Se han desarrollado anticuerpos monoclonales que se unen directamente al receptor inhibiendo la unión con el factor decrecimiento lo que permite bloquear la proliferación, dentro de estas moléculas se encuentra el trastuzumab utilizado en cáncer de mama y el cetuximab que tiene uso en el cáncer avanzado de colon, mama y ovario10.
Una vez que se inicia el crecimiento de la masa tumoral, ésta requiere una adecuada vascularización. Ello implica que las células tumorales tienen que producir factores que favorezcan la formación de nuevos vasos o la ramificación de los cercanos, proceso conocido como angiogénesis. La principal proteína relacionada es FCEV, por lo cual se ha creado el bevacizumab que es un anticuerpo capaz de bloquear el receptor tirosin kinasa de este factor de crecimiento inhibiendo la angiogénesis10.
Las tirosin kinasas no relacionadas con receptores son enzimas citoplasmáticas que se autoestimulan por anormalidades celulares, como ocurre en la leucemia mieloide crónica en donde la traslocación de cromosomas 9 y 22 produce un gen de fusión conocido como BCR-ABL que lleva a una división celular no controlada. Estas enzimas pueden ser inhibidas por drogas como el imatinib, dasatinib, sunitinib, entre otras12.
Para que se lleve a cabo la replicación celular es fundamental el proceso de mitosis, con la duplicación del material genético y la formación de dos células hijas. En este punto es donde los citotóxicos clásicos actúan interrumpiendo este proceso. Estos medicamentos se dividen en agentes alquilantes, análogos de los platinos, antimetabolitos, inhibidores de la topoisomerasa I y II y agentes anti microtúbulos13.
Los agentes alquilantes fueron los primeros fármacos descubiertos, como se describió previamente. El grupo alquil resulta de la pérdida de un átomo de hidrógeno en un grupo de hidrocarbono alifático o aromático lo cual lleva a formar enlaces covalentes con otros compuestos. La principal acción es atacar el nitrógeno de la guanina en el ácido desoxirribonucleico (ADN) y el ácido ribonucleico (ARN). Al encontrarse dos grupos alquil se forman enlaces que no se pueden romper en el momento de la replicación celular, llevando a detener este proceso. Dentro de los principales agentes alquilantes se encuentran la ciclofosfamida, la ifosfamida, la dacarbazina y el clorambucil13.
Los análogos de los platinos se desarrollaron al observar cómo se inhibía el crecimiento bacteriano al pasar una corriente eléctrica a través de dos electrodos de platino. La activación de estos medicamentos lleva a formar puentes cruzados con el ADN de manera similar que los agentes alquilantes, como ejemplo se encuentra el cisplatino y el oxaliplatino13.
Los antimetabolitos fueron la segunda familia de medicamentos en descubrirse. EL ADN está compuesto de miles de subunidades denominadas nucleótidos, que a su vez están formados por tres componentes: un grupo fosfato, una pentosa y una base nitrogenada que puede ser una purina o pirimidina. Para que estas últimas puedan formarse, es fundamental el ácido fólico como co-enzima. El proceso metabólico se inicia con la conversión a ácido folínico posteriormente a dihidrofolato y finalmente a tetrahidrofolato por la enzima dihidrofolato reductasa. El metotrexate inhibe la formación de ácido folínico a partir de ácido fólico. Otros medicamentos como la mecartopurina o la pentostatina detienen la formación de purinas. El fluorouracil, el capecitabine, el gemcitabine y el tegafur impiden la síntesis de pirimidinas13.
La topoisomerasas son enzimas que ayudan en la síntesis de ADN y mantienen su estructura, al inhibirlas se producen rupturas en las cadenas, lo que finalmente lleva a la muerte de la célula. Las antraciclinas como doxorrubicina, epirrubicina y mitoxantrona actúan directamente sobre la topoisomerasa II y son capaces además de producir radicales de oxígeno que finalmente desencadenan la apoptosis13.
Una vez que la célula tumoral ha completado el proceso de síntesis y duplicación del material genético, se produce el proceso de la mitosis el cual requiere la formación del huso mitótico (conjunto de microtúbulos que tiene como función conducir a los cromosomas durante los procesos de reproducción celular a cada una de las células hijas). Esta estructura requiere el ensamblaje de los microtúbulos, proceso que a su vez es inhibido por agentes como los taxanos (paclitaxel) o los alcaloides vinca que va llevar a detener la mitosis13. De esta forma y para tener en mente el tipo de medicamentos utilizados en los tratamientos oncológicos, teniendo en cuenta su mecanismo de acción se clasifican según la Tabla 1.
Tabla 1. Clasificación de medicamentos quimioterapéuticos según el mecanismo de acción
Manifestaciones clínicas de la cardiotoxicidad
Los principales agentes quimioterapéuticos asociados a complicaciones cardíacas han sido las antraciclinas. Sin embargo, otros medicamentos como ciclofosfamida, ifosfamida, cisplatino, carmustina, busulfan, mitomicina, paclitaxel, etopósido, tenipósido, los alcaloides de vinca, fluorouracilo, citarabina, amsacrina, asparginasa, treotonina, pentostatina, además de ser múltiples modificadores de la respuesta biológica, pueden también ocasionar lesión a nivel cardiovascular (Figura 3)14.
Figura 3. Efectos cardiovasculares de los medicamentos para la quimioterapia.
Medicamentos relacionados con falla cardíaca
Las antraciclinas son un grupo de antibióticos citotóxicos que fueron inicialmente extraídos del hongo Streptomyces. Son medicamentos muy efectivos contra un amplio espectro de neoplasias sólidas y hematológicas, haciendo parte de muchos regímenes curativos15. A pesar de lo anterior, la cardiotoxicidad sigue siendo uno de los principales elementos que limitan su utilización, especialmente, en altas dosis con una presentación que va del 4 al 36%. Los principales factores de riesgo para desarrollar falla cardíaca por estos agentes citotóxicos son la dosis acumulada (por ejemplo dosis mayores de 550 mg/m2 de doxorrubicina), edad mayor a 70 años, irradiación temprana o simultánea, uso de otros fármacos que lesionan al miocito como trastuzumab o taxanos y enfermedad cardíaca previa16.
El trastuzumab es un anticuerpo monoclonal dirigido al dominio extracelular del receptor del HER2, el cual es fundamental para la diferenciación y el crecimiento celular. La amplificación del gen HER2/neu ocurre en el 25-30% de las pacientes con diagnóstico de cáncer de mama, esta mutación se asocia a mal pronóstico17,18. Este anticuerpo ha demostrado ser útil en estudios clínicos y preclínicos como monoterapia o como parte del manejo combinado en pacientes con neoplasias de la glándula mamaria, disminuyendo la recurrencia, aumentando las medianas de sobrevida y reduciendo el tamaño tumoral19,20. La incidencia de cardiotoxicidad por trastuzumab varía desde 3-7% si se utiliza como agente único o hasta 27% durante el manejo combinado4,21. La incidencia de disfunción ventricular izquierda en pacientes que reciben este anticuerpo monoclonal se incrementa también en pacientes ancianos con enfermedad cardiovascular previa, con antecedente de quimioterapia y radioterapia previa. Los efectos cardiovasculares han disminuido progresivamente en los estudios recientes dado que hay mejor monitoreo, tanto antes como después del tratamiento, y se evita el uso en combinación con antraciclinas. Por otro lado, es importante destacar que la disfunción cardíaca mediada por trastuzumab es reversible al suspender la medicación, con recuperación casi completa de la fracción de eyección en aproximadamente 1,5 años, convirtiéndose en una diferencia importante con respecto a la toxicidad mediada por antraciclinas.
La ciclofosfamida es un medicamento perteneciente al grupo alquilante, es decir que actúa directamente en el ADN formando enlaces covalentes y por tanto causando inhibición de la replicación celular, por lo cual se considera actualmente la piedra angular en varios esquemas de quimioterapia. Las altas dosis de ciclofosfamida se han relacionado con cardiotoxicidad aguda dentro de los 10 días de la aplicación, especialmente cuando se combina con otros agentes cardiotóxicos22,23. Esta medicación se ha relacionado con la aparición de miopericarditis aguda y complicaciones asociadas como arritmias, taponamiento cardíaco, falla cardíaca, entre otras. El único factor de riesgo reproducible es una dosis total de más 170-180 mg/kg por ciclo. La incidencia es variable, pero en series de casos publicadas se encuentra desde 11 al 22%24,25.
La mitomicina es un agente alquilante que interfiere directamente con la estructura y función del ADN. Este fármaco se ha asociado con el desarrollo de cardiomiopatía con disfunción del ventrículo izquierdo (VI), especialmente cuando se administra al tiempo o después de las antraciclinas y depende directamente de la dosis acumulada26.
Imatinib, dasatinib y nilotinib son moléculas diseñadas para el manejo de la leucemia mieloide crónica que expresa el cromosoma Filadelfia, el cual codifica una proteína de fusión conocida como BCR-ABL (BCR: breakpoint cluster region - ABL: Abelson), estos fármacos compiten con el ATP (adenosina trifosfato) en la enzima ABL kinasa y de esta forma inhiben su acción, induciendo a muerte celular por apoptosis, además de tener efectos negativos en el receptor de factor de crecimiento derivados de las plaquetas y el gen relacionado con ABL. Otras indicaciones de estas medicaciones son la leucemia linfoblástica aguda con expresión de cromosoma Filadelfia, leucemia eosinofílica crónica y tumores del estroma gastrointestinal (GIST)27. Los primeros casos de cardiotoxicidad por imatinib fueron reportados por Kerkela y colaboradores que encontraron, en 10 pacientes que recibían tratamiento con imatinib, una disminución de la función del ventrículo izquierdo asociada a una pérdida de la masa miocárdica. Actualmente, se sabe que la incidencia de los efectos cardiovasculares por estos fármacos es baja, aproximándose al 0,5-1,7%, pero que no debe ser despreciada en la población añosa28-31.
Medicamentos relacionados con isquemia
Muchos agentes desarrollados para el manejo de neoplasias se asocian a desarrollo de un síndrome coronario agudo, por ejemplo las infusiones de cisplatino (medicamento que interfiere directamente con la función y la estructura del ADN), pudiendo producir dolor torácico, palpitaciones y en los casos más severos elevación de las enzimas cardíacas32.
El 5 fluorouracilo (5 FU), medicamento que actúa inhibiendo la síntesis del material genético al ser similar a las pirimidinas, puede también ocasionar un síndrome coronario agudo que puede ir desde una angina inestable hasta un infarto agudo al miocardio (IAM), lo cual es dependientede la dosis y de la velocidad de administración. Una vez suspendida la medicación y con el manejo anti isquémico adecuado, suelen revertirse todos los efectos. La incidencia en pacientes sin enfermedad coronaria previa es del 1,1%, pero puede llegar hasta el 4,5%, cuando existe este antecedente33.
Capecitabine, un derivado del 5 FU utilizado para el manejo de cáncer de colon y mama principalmente, se ha asociado a efectos cardiotóxicos que incluye angina, IAM, arritmias, cambios electrocardiográficos y cardiomiopatía34.
Los agentes antimicrotúbulos como los alcaloides de vinca o los taxanos también se han asociado con el desarrollo de angina con cambios en el electrocardiograma (ECG), isquemia miocárdica e IAM. En ocasiones también, se han asociado con la presencia de angina de Prinzmetal con cambios reversibles, lo cual sugiere como mecanismo de presentación el vasoespasmo coronario35.
Por último, el bevacizumab, un anticuerpo monoclonal cuya función es inhibir la activación del factor de crecimiento derivado del endotelio, se ha asociado recientemente con el desarrollo de eventos trombóticos arteriales, dentro de ellos el IAM36.
Medicamentos relacionados con hipertensión arterial e hipotensión arterial
El principal medicamento relacionado con hipertensión arterial severa es el bevacizumab. En muchos de los estudios puede ser tan frecuente como el 5%, pero muy pocas veces se ha asociado a crisis hipertensivas de emergencia. Otra medicación relacionada con hipertensión es el interferón alfa, especialmente, en las primeras 2 a 8 horas de utilización37.
La hipotensión arterial, por otra parte, resulta principalmente de la utilización de algunos agentes quimioterapéuticos como el etopósido e infusiones de anticuerpos monoclonales, también llamada terapia blanco. Dentro de éstos se encuentra el alemtuzumab, un anticuerpo dirigido al CD52 y utilizado en el manejo de la leucemia de células T, cuya infusión se asocia a reacciones de hipotensión, broncoespasmo y rash durante la primera semana de la terapia.
El cetuximab, un anticuerpo quimérico (humano/ratón) que se une al receptor de crecimiento epidérmico y por lo tanto inhibe el crecimiento de muchas neoplasias, produce en el 3% de los pacientes reacciones de hipersensibilidad severa con hipotensión asociada38.
Otros medicamentos pertenecientes a la terapia blanco que se asocia a hipotensión severa son el rituximab, IL2 y el ácido trasretinoico.
Medicamentos relacionados a arritmias
Es frecuente encontrar arritmias durante el tratamiento del cáncer, éstas puede abarcar un gran espectro que va desde las bradiarritmias hasta las taquiarritmias ventriculares y supraventriculares. Dentro de los principales fármacos responsables del desarrollo de trastornos del ritmo están las antraciclinas. El primer signo de cardiomiopatía por estos antibióticos, muchas veces, es una taquicardia sinusal; no obstante, no son infrecuentes las arritmias supraventriculares, los cambios en el ST, cambios dinámicos de la onda T, ectopia ventricular y en pocos casos arritmias ventriculares39.
Los taxanos, medicamentos que actúa directamente sobre los microtúbulos, también se han relacionado con el desarrollo de arritmias hasta en un 30% de los casos, especialmente, de bradicardia asintomática que raramente requiere la suspensión de la medicación. Se han reportado también casos de bloqueos aurículo-ventriculares (AV), bloqueo de rama y taquicardia sinusal40.
Otros medicamentos como el trióxido de arsénico, utilizado en el manejo de la leucemia promielocítica, también se ha asociado a la prolongación del intervalo QT41.
Mecanismos de cardiotoxicidad
Lesión del miocardio
La lesión del miocardio se produce por 2 tipos de mecanismos: la cardiotoxicidad tipo 1 cuyo ejemplo clásico son las antraciclinas y la cardiotoxicidad tipo 2, principalmente, producida por el trastuzumab (Figura 4).
Figura 4. Mecanismos por los cuales los medicamentos utilizados para la quimioterapia producen lesión cardiovascular.
El mecanismo por el cual las antraciclinas producen daño cardíaco es probablemente multifactorial42. La liberación de radicales libres, la alteración en la homeostasis del hierro, cambios en el calcio intracelular y disfunción mitocondrial son algunos de los efectos producidos por estos antibióticos39.
El mecanismo más conocido es la vía del daño mediado por radicales libres. La reducción del grupo quinona en el anillo B de los antracíclicos lleva a la formación de un radical de semiquinona. Este compuesto se oxida rápidamente generando radicales superóxido los cuales dan lugar a la formación de peróxido de hidrógeno. A su vez, este último va interaccionar con el miocardio que es muy susceptible de daño, dado que tiene menor cantidad de superóxido dismutasa y catalasa que otros tejidos y su única defensa es la glutation peroxidasa que se encuentra reducida por estos medicamentos43.
La formación de un complejo hierro férrico con la doxorrubicina va a catalizar la reacción anterior, aumentando la generación de radicales libres y a su vez éstos van a contribuir en la conversión de hierro ferroso a férrico, lo cual no es más que un círculo vicioso que va llevar a la destrucción de las membranas mitocondriales, nucleares, la membrana celular y del retículo endoplásmico. El daño de este último produce descenso del calcio intracelular, produciendo por lo tanto disminución de la contractibilidad44.
Las citoquinas proinflamatorias también se han relacionado con los efectos cardiovasculares de las antraciclinas, dado que éstas inducen la liberación de histamina, factor de necrosis tumoral alfa e interleucina 2. Estas proteínas inducen cardiomiopatía dilatada además de disfunción beta adrenérgica45.
Por otro lado, la toxicidad cardíaca por trastuzumab no esdel todo entendida. Inicialmente, se consideraba que estaba relacionada con el uso de antraciclinas, pero existen pacientes que nunca recibieron manejo con estos antibióticos y desarrollaron signos de falla cardíaca46. Las complicaciones cardíacas por estos anticuerpos monoclonales a diferencias de las antraciclinas, no ocurren por el medicamento en sí, sino por el bloqueo de las vías de reparación celular que ocurren al inhibir al receptor HER2, llevando fi nalmente a acelerar el proceso de muerte de los miocitos y disminuir la recuperación funcional47.
Otros medicamentos, como los inhibidores de la tirosin kinasa, no producen cardiotoxicidad por los mecanismos previamente descriptos, sino que se han asociado a disfunción mitocondrial. Los cardiomiocitos presentan altas demandas de ATP, por lo cual son susceptibles a cualquier disfunción de la mitocondria. Las principales alteraciones que se han encontrado en estos organelos son la pérdida del potencial de membrana, liberación de citocromo c y disminución importante de los niveles de ATP, lo que fi nalmente conlleva a la muerte de los miocitos. El mecanismo es complejo, pero se inicia con la generación de proteínas no plegadas que estimulan la respuesta de estrés del retículo endoplásmico, activando 2 vías distintas de transducción de señales: PERK y IRE1 cuyo resultado fi nal será la activación de la muerte celular programada48.
Alteraciones de la coagulación
El cáncer, como es sabido desde los primeros reportes del doctor Trosseau en 1865, es un estado de hipercoagulabilidad y el riesgo de presentar eventos está en relación con el estadio de la enfermedad, las comorbilidades y con el tratamiento utilizado49.
La quimioterapia tiene efectos directos en el sistema de coagulación, favoreciendo la trombosis y el tromboembolismo, y como consecuencia eventos cardiovasculares e isquemia cerebrovascular.
Los medicamentos como la talidomida, la lenidomida y el bevacizumab, los cuales inhiben la angiogénesis, se han asociado a eventos trombóticos. El mecanismo exacto no es conocido, pero se ha asociado a daño directo del endotelio especialmente de las uniones de las células y daño de la capa intimal, activando la cascada de coagulación50,51.
Otros medicamentos como los platinos tienen efectos directos en la agregación de las plaquetas, facilitando la formación de tromboxano y activando la vía del ácido araquidónico dentro de éstas52.
Hipertensión arterial
Los principales medicamentos asociados a hipertensión arterial, como se describió previamente, son bevacizumab, sorafenib y sunitinib. El mecanismo asociado por el que se produce la hipertensión no es del todo entendido, pero se considera que al inhibir el factor de crecimiento derivado del endotelio disminuye la síntesis de óxido nítrico en las arteriolas y otros vasos de resistencia, lo cual provoca vasoconstricción e hipertensión arterial53.
Principales factores de riesgo para la cardiotoxicidad inducida por quimioterapia y su valoración
La valoración del riesgo cardiovascular en los pacientes que van a ser llevados a quimioterapia debe ser realizada previo al inicio de ésta, con el fi n de realizar las modifi caciones necesarias. Para ello, es importante valorar el esquema de antineoplásicos que recibirá el paciente, las dosis de losfármacos a utilizar, las medidas de prevención utilizadas, además de factores individuales como edad, sexo, antecedentes familiares y personales de enfermedad cardíaca, sin olvidar algunas herramientas como el examen físico que orientara al clínico sobre el riesgo del paciente37,42,54. Con el fin de evaluar el riesgo, podría utilizarse la lista de chequeo que se enuncia en la Tabla 2.
Tabla 2. Lista de chequeo que se debe realizar para evaluar los pacientes que van a recibir o se encuentran en quimioterapia
La cardiotoxicidad puede aparecer a cualquier edad, sin embargo, a mayor edad la probabilidad de presentar complicaciones también asciende55. Las mujeres tienen mayor riesgo de presentar eventos cardiovasculares con el uso de quimioterapia, a pesar de que los hombres tienen mayor posibilidad de desarrollar aterosclerosis, lo cual debe ser tenido en cuenta por los oncólogos, cardiólogos o médicos que valoren a estos pacientes55.
A su vez, a mayor dosis acumulativa también mayor riesgo de desarrollar toxicidad y la velocidad de aplicación, ejemplo claro de esto se da con el uso de antraciclinas como la doxorrubicina por encima de 450 mg/m2, la daunorrubicina en dosis superiores a 900 mg/m2 y la epirrubicina mayor de 935 mg/m2. No debe ser tampoco olvidado que la radioterapia mediastinal concomitante con la quimioterapia facilita la aparición de complicaciones cardiovasculares5.
De un estudio realizado de riesgo cardiovascular en pacientes con cáncer que iban a recibir manejo con inhibidores de la tirosin kinasa, se encontró que el 9,3% de los pacientes presentaba historia de enfermedad cardiovascular. Además, muchos de los pacientes presentaban factores de riesgo como hipertensión arterial (48,8%), diabetes mellitus (22%) o hipertrigliceridemia (12,8%), lo cual revela que la enfermedad cardiovascular es frecuente y subestimada en los pacientes con cáncer; por lo que debe ser indagado en el momento de considerar cualquier esquema de manejo57.
Diagnóstico y detección temprana
A medida que aparecen más agentes antineoplásicos, crece el interés sobre la detección temprana de los efectos tóxicos, entre ellos la cardiotoxicidad tanto temprana como en los sobrevivientes del cáncer56. La mayoría de los métodos diagnósticos han sido evaluados con las antraciclinas y el trastuzumab.
Existen dos métodos no invasivos que se han utilizado en la práctica oncológica para evaluar las complicaciones cardíacas relacionadas con el uso de antineoplásicos: la ecocardiografía y la ventriculografía con radionúclidos.
El ecocardiograma es una técnica de ultrasonografía con la cual se logra evaluar en tiempo real muchas condiciones, dentro de las que se encuentran la movilidad global del miocardio (disfunción sistólica y diastólica), derrames pericárdicos, alteraciones valvulares y cuantificar la fracción de eyección, siendo recomendado por varias asociaciones americanas como American College of Cardiology, American Heart Association y American Society of Echocardiography para monitorizar pacientes que se encuentran en tratamiento con antracíclicos58-60. Aunque la fracción de eyección aportada por el ecocardiograma Doppler es muy utilizada, es de recordar que no es un parámetro muy sensible para detectar alteraciones tempranas en la función miocárdica, y ahora se reconoce que los índices diastólicos representan un signo temprano de la disfunción del VI en pacientes con cáncer, por lo que la evaluación del patrón del flujo diastólico mitral, el índice E/A (velocidad protodiastólica/ telediastólica), el tiempo de desaceleración de la onda E, el tiempo de relajación isovolumétrica, pueden servir para detectar cambios diastólicos del ventrículo izquierdo.
El Doppler tisular del anillo mitral lateral del VI tiene un reconocido papel pronóstico y, en combinación con el Doppler pulsado del llenado de la válvula mitral, suministra una información adecuada acerca de las presiones de llenado del ventrículo izquierdo60. La principal desventaja es que es observador dependiente; y en el caso de los pacientes con neoplasias, las alteraciones en la pared torácica secundarias a manejo quirúrgico o radioterapia o simplemente las complicaciones por el tumor como derrames pleurales o compromiso de la pared, pueden afectar la ventana de observación y por tanto cambiar los resultados obtenidos61,62.
La ventriculografía por radionúclidos es un test funcional de medicina nuclear que se realiza con la aplicación de eritrocitos marcados con un radiomarcardor que posteriormente se visualiza en la cámara gamma, permitiendo evaluar la función sistólica y diastólica; pero no es posible obtener información sobre las estructuras cardíacas. Esta prueba es válida y ha sido utilizada en varios estudios, dado que es reproducible sin ser dependiente del operador, su principal desventaja es la radiación a la cual se somete el paciente62-64.
A su vez han aparecido estudios con marcadores cardíacospara detectar tempranamente la toxicidad, como son la troponina y el péptido natriurético.
Las troponinas son proteínas cardíacas cuya función es la de regular la interacción de la actina y la miosina durante la contracción del miocardio. La detección se realiza mediante anticuerpos monoclonales que detectan las isoformas de troponina I y troponina T, es una prueba muy específica de daño cardíaco, marcador específico y sensible para la detección de isquemia miocárdica. Su elevación se ha informado como predictor de morbilidad cardíaca subclínica y clínica, en pacientes con antraciclinas65-67. Por estos hallazgos se considera que la troponina puede ser un marcador temprano de daño cardíaco.
El péptido natriurético atrial cumple varias funciones fisiológicas como disminuir la tensión arterial, y tiene efecto diurético y natriurético. Se considera actualmente como marcador de pronóstico y respuesta al tratamiento en la falla cardíaca aguda y crónica, pero aún son pocos los estudios que han indicado su utilidad en el manejo de los pacientes con cáncer. Su valor puede tener lugar cuando la falla cardíaca es aún clínicamente inaparente. Sin embargo, nuevos estudios deberán confirmar la sensibilidad y la especificidad de este parámetro.
El estándar de oro para detectar la cardiotoxicidad por quimioterapia sigue siendo la biopsia endomiocárdica68. Los principales hallazgos son la pérdida de miofibrillas, la presencia de vacuolas, la alteración de las líneas Z y la fibrosis69. Existe una relación positiva entre los cambios observados y la dosis acumulada, especialmente de antraciclinas.
Monitoreo, prevención y tratamiento
En mayo del 2010 por parte del grupo europeo de oncología60, se publicaron las guías de práctica clínica acerca de cardiotoxicidad de agentes quimioterapéuticos y radioterapia, haciendo las siguientes recomendaciones:
Evaluación cardiovascular de pacientes antes del tratamiento de medicamentos antineoplásicos
- Todos los pacientes sometidos a quimioterapia deben tener una evaluación clínica cuidadosa donde se evalúen los factores de riesgo cardiovascular o las comorbilidades [A].
- Recomiendan la monitorización frecuente de signos vitales durante la infusión de los agentes quimioterapéuticos, en particular con 5-FU o paclitaxel [A].
- El ECG y la evaluación clínica cardiovascular son útiles para la detección de signos de cardiomiopatía, trastornos de la conducción, valoración del intervalo QT, previo al inicio de quimioterapéuticos en especial con el uso de antraciclinas, paclitaxel o inhibidores de tirosin kinasa [B].
- El ecocardiograma Doppler se debe solicitar para evaluar la función cardíaca en pacientes sometidos a la terapia con antraciclinas, en particular ante la presencia de factores de riesgo cardiovascular como lo son edad >60 años, enfermedad cardiovascular previa e irradiación del mediastino anterior y en pacientes sometidos a terapia con trastuzumab, en particular en pacientes previamente tratados con antraciclinas [A].
- La fracción de acortamiento de ventrículo izquierdo y la fracción de eyección del ventrículo izquierdo son los índices más comunes para la evaluación de la función cardíaca antes de iniciar el tratamiento oncológico: una FEVI <54% se identifica como un factor de riesgo para el desarrollo de falla cardíaca en pacientes sometidos a tratamiento con trastuzumab.
- La adquisición de imágenes mediante gammagrafía miocárdica permite información de la fracción de eyección, pero su uso es limitado debido a la exposición a la radiación.
- El uso de la resonancia magnética para evaluar la función del miocardio, la perfusión miocárdica y la caracterización de los tejidos, actualmente, no es una prueba de primera línea, pero puede tener potencial en el futuro.
Recomendaciones para monitoreo de cardiotoxicidad
- Los pacientes sometidos a terapia oncológica deben ser educados para la reducción de riesgo cardiovascular, a través del control de la presión arterial, la reducción de niveles de lípidos, dejar de fumar y realizar modificaciones en el estilo de vida.
- El control periódico de la función cardíaca con ecocardiograma Doppler es sugerido en pacientes que reciban especialmente antraciclinas y sus derivados, o anticuerpos monoclonales.
- La evaluación clínica basal con ECG se recomienda en todos los pacientes sometidos a terapia con antraciclinas [III, A].
- La evaluación de la función cardíaca basal sistólica y diastólica con ecocardiograma Doppler debe llevarse a cabo antes del tratamiento con anticuerpos monoclonales [III, A] o antraciclinas y sus derivados en los pacientes mayores de 60 años, o con factores de riesgo cardiovascular como hipertensión, dislipidemia, diabetes, obesidad o tratamiento previo con agonistas 5 hidroxitriptamina 2B (usados en el Parkinson o la obesidad) dado que potencialmente pueden inducir valvulopatías [III, A].
- Otras evaluaciones de la FEVI se recomiendan, incluso en pacientes asintomáticos, de acuerdo con los siguientes tiempos: después de la administración de la mitad de la dosis prevista de antraciclina, o después de la administración de la dosis acumulada de doxorrubicina 300 mg/m2, epirubicina 450 mg/m2 mitoxantrona 60 mg/ m2 [III, A] o después de la administración de una dosis acumulada de 240 mg/m2 de doxorrubicina o epirrubicina 360 mg/m2 en pacientes <15 años ó >60 años [III, B]. Antes de cada administración de ciclo de antraciclinas [III, A], después de 3, 6 y 12 meses de la finalización deterapia con antraciclinas [III, B].
- Durante el seguimiento de variables ecocardiográficas, los patrones del Doppler pulsado del tracto de entrada del ventrículo izquierdo y el Doppler tisular del anillo mitral deberían ser evaluados para detectar signos de disfunción ventricular izquierda que se pueden presentar antes de la disminución de la fracción de eyección.
- El control periódico (cada 12 semanas) de la función cardíaca es sugerido también a los pacientes que recibieron anticuerpos monoclonales, sobre todo si previamente habían sido tratados con antraciclinas [III, A].
- La evaluación de la función cardíaca se recomienda 4 y 10 años después del tratamiento con antraciclinas en pacientes que fueron tratados <15 años de edad [III, B], o incluso a la edad >15 años, pero con dosis acumulativa de doxorubicina de> 240 mg/m2 o epirubicina >360 mg/ m2 [III, B].
- La reducción de la FEVI <20% de la basal, a pesar de una función ventricular adecuada o una declinación de la FEVI <50% requiere reevaluación o la suspensión del tratamiento y seguimiento clínico estricto.
- No hay un papel predictivo de biomarcadores de cardiotoxicidad causado por la terapia oncológica bien definido, como para ser medidor de rutina. Sin embargo, un aumento persistente de troponina I o del péptido natriurético cerebral (BNP) parece identificar pacientes con riesgo de cardiotoxicidad (excepto en pacientes que presentan síndrome de secreción inadecuada de la hormona antidiurética -HAD para el último), un enfoque útil, pero controvertido por lo costoso, es la medición basal de estos biomarcadores durante el tratamiento (troponina I al final de la administración de quimioterapia, después de 12, 24, 36,72 horas y 1 mes después) y el BNP al finalizar la infusión de medicamento y a las 72 horas; para identificar los pacientes que necesitan más evaluación cardíaca [III, C].
Tratamiento
El tratamiento médico agresivo de aquellos pacientes que incluso asintomáticos, muestran disfunción del VI en el ecocardiograma después de la terapia con antraciclinas, es obligatorio; especialmente, si la neoplasia podría tener una supervivencia a largo plazo, y consiste en inhibidores de la enzima convertidora de angiotensina (IECA) y beta bloqueadores.
Una vez desarrollados los síntomas debe añadirse al manejo: diuréticos, antagonistas de aldosterona, digoxina o nitratos, según las pautas internacionales. En el momento no existen estudios que muestren beneficio del manejo anterior para prevenir la progresión de la cardiopatía y muy pocos han demostrado beneficios terapéuticos a largo plazo70.
Con el fin de evitar las complicaciones cardiovasculares asociadas a estos antibióticos, se han desarrollado estrategias preventivas. Dentro de las principales, se ha considerado el cambio en el esquema de administración: se modificó la aplicación de bolos por infusiones prolongadas, lo cual ha disminuido el riesgo de cardiotoxicidad, pero no ha mostrado beneficios en la tasa de respuesta y la supervivencia global71.
Otro mecanismo que se diseñó fue cubrir las antraciclinas con una cápsula liposomal, lo cual tiene efectos directos en la farmacocinética, dado que el mayor tamaño le impide atravesar el endotelio normal y el miocardio, pero sí puede difundir al tumor. Esto aporta a estas moléculas una eficacia similar, pero menor riesgo de desarrollar falla cardíaca, lo cual es demostrado en biopsias donde se observan menos cambios miocárdicos al comparar estos compuestos con la doxorrubicina72.
Otros análogos como la epirrubicina y la mitoxantrona han demostrado tener menos potencia terapéutica que la doxorrubicina, pero a su vez con menos cardiotoxicidad73,74. La mitoxantrona se asocia a disfunción cardíaca con dosis acumulada de 140 mg/m2, pero responde muy bien a la terapia estándar de falla cardíaca74.
El dexrazoxane es un agente similar al ácido etilendiaminotetracetico (EDTA) que actúa como quelador del hierro y por tanto inhibe la peroxidación de las membranas lipídicas; por este efecto actualmente se utiliza para prevenir la cardiotoxicidad inducida por antraciclinas75. El dexrazoxane puede ser administrado de dos maneras: la primera al iniciar el tratamiento o al completar la dosis acumulada de 300 mg/m2. Muchos estudios han demostrado que el uso concomitante con estos antibióticos puede reducir el daño a nivel cardiovascular76. A pesar de este beneficio, su uso continúa siendo controversial por la posibilidad de disminuir la respuesta a la quimioterapia y incrementa la inmunosupresión inducida por las antraciclinas77,78.

Por tanto la recomendación final de un manejo multidisciplinario en el que la interrelación del oncólogo, cardiólogo y la monitorización permanente desde el punto de vista clínico cardiológico y ecocardiográfico, sería un paso importante en la identificación temprana de los pacientes con toxicidad cardíaca secundaria a la quimioterapia79,80.
Conclusión
Así como los quimioterapéuticos han dado lugar a un aumento en la esperanza de vida de muchos pacientes, las comorbilidades relacionadas con el tratamiento se han convertido en un problema para los sobrevivientes de cáncer a largo plazo. La cardiotoxicidad es uno de los más temidos efectos secundarios de estos agentes, cuyas manifestaciones clínicas son muy diversas y pueden ir desde la isquemia y las arritmias, hasta la disfunción ventricular reversible e irreversible. Los mecanismos por los que se producen son muy diversos y no siempre similares a su efecto citotóxico. Existen factores de riesgo dentro de los cuales se encuentran la edad, la dosis acumulada, la velocidad de infusión y la presencia de enfermedad cardiovascular previa; éstos deben ser tenidos en cuenta en el momento de decidir qué esquema de quimioterapia va a recibir el paciente. Los métodos diagnósticos preferidos son el ecocardiograma y la ventriculografía radioisotópica, cada uno con ventajasy desventajas. Ya existe una guía de práctica internacional para el monitoreo y prevención, la cual se debe en la medida cumplir estrictamente. Pero hay que recordar que la piedra angular del tratamiento es la prevención; para ello se han diseñado nuevas moléculas como el dezrazone el cual quela el hierro e inhibe los efectos cardiovasculares de las antraciclinas. En caso de presentarse complicaciones cardiovasculares, el manejo es sintomático siguiendo los lineamiento internacionales.
Suscribirse a:
Entradas (Atom)