La isquemia miocárdica en la actualidad es la principal causa identificable de mortalidad y morbilidad cardiovascular en las sociedades occidentales. La palabra isquemia proviene de la unión de dos palabras griegas: ischo, que significa retirar, y haima, que significa sangre. Como su propio nombre indica significa básicamente que el aporte sanguíneo al miocardio es inadecuado.
La primera descripción de la isquemia muscular fue realizada en 1809 por John Burns (1774-1850), un cirujano del Royal Infirmary de Glasgow. De forma puramente intuitiva, la relacionó con un desequilibrio entre la oferta y la demanda de energía en el músculo de una extremidad sometida a un ejercicio vigoroso y con una ligadura proximal.
En los últimos 30 años hemos asistido a importantes avances en el campo de la isquemia miocárdica, que nos han permitido conocer de forma más profunda una serie de fenómenos con importantes repercusiones terapéuticas y diagnósticas. Especialmente a partir de 1978, se han desarrollado tres nuevos conceptos relacionados con la isquemia y que nos permiten comprender mejor su fisiopatología. Nos referimos a los conceptos de aturdimiento, desarrollados por Heyndrickx et al (1978), Braunwald et al (1982); hibernación, descrita por Braunwald et al y completada por Rahimtoola, y de preacondicionamiento del miocardio isquémico, descrito por Murry et al en 1986.
En este capítulo de la monografía se revisa lo que se conoce en la actualidad sobre la fisiopatología de la isquemia miocárdica y sus posibles factores modificadores, con sus efectos en el miocardio aturdido, hibernado y el preacondicionamiento isquémico.

FISIOPATOLOGÍA DE LA ISQUEMIA MIOCÁRDICA
La isquemia ocurre cuando la demanda de oxígeno del músculo cardiaco supera el aporte. Es necesario analizar los determinantes del aporte y la demanda de oxígeno al corazón para entender la fisiopatología de la isquemia

Determinantes de la demanda de oxígeno del miocardio
El corazón necesita energía para mantener sus estructuras y funcionalidad basal y para cumplir con su función, bombear sangre a los tejidos. El corazón debe realizar un cierto trabajo para empujar ese volumen de sangre hacia los tejidos en contra de una presión; resulta obvio que dicho trabajo está en relación directa con el volumen de sangre que debe desplazar y con la presión que debe superar. La demanda de oxígeno aumenta cuando aumenta el trabajo que debe desarrollar.
En la fórmula del trabajo cardiaco encontramos las variables que pueden hacer que aumenten las necesidades de oxígeno del miocardio. En primer lugar, el volumen de sangre bombeado, que no es otro que el volumen minuto (VM), y en segundo lugar, la presión arterial sistólica. El VM depende del volumen de cada latido y de la frecuencia cardiaca. El VM es el volumen al final de la diástole menos el volumen al final de la sístole. El volumen al final de la diástole depende principalmente del retorno venoso (precarga) y de la rigidez de la pared ventricular (estrés de la pared). El volumen al final de la sístole depende de la capacidad de contracción del músculo cardiaco (contractilidad). Por tanto, las cuatro variables que influyen directamente en el trabajo y el consumo de oxígeno del corazón son: frecuencia cardiaca, presión sistólica, estrés o tensión de la pared del ventrículo y contractilidad miocárdica.
La contractilidad miocárdica y el estrés de la pared son de difícil medición. Katz5, Braunwald et al2 y Sarnoff et al6 demostraron que el consumo de oxígeno por minuto en el corazón es proporcional a un índice de tensión-tiempo por minuto, que corresponde a la presión sistólica media multiplicada por la duración de la sístole y por la frecuencia cardiaca. Por estos motivos, en la práctica clínica habitual se utiliza el denominado doble producto, resultado de la multiplicación entre la frecuencia cardiaca y la presión sistólica. La medición del doble producto es útil para valorar de una forma objetiva los resultados de los distintos tratamientos sobre el umbral de isquemia.
Aunque el consumo de oxígeno es un buen índice de la liberación metabólica de energía en condiciones estables, un concepto más evolucionado es el de la eficiencia cardiaca o relación entre el trabajo realizado y el oxígeno consumido.
Los aumentos de presión arterial tienen poco efecto en la eficiencia cardiaca. Cuando se aumenta la poscarga para un volumen y una frecuencia cardiacas constantes, el aumento de trabajo requiere un aumento proporcional en el oxígeno aportado, puesto que hay una relación proporcional entre consumo de oxígeno y presión. En la estenosis aórtica y en la hipertensión, puede haber hipoxia del miocardio por este aumento del consumo de oxígeno, que conduce a la insuficiencia cardiaca.
Cuando aumenta el volumen latido manteniendo constantes la presión y la frecuencia cardiaca, se produce un aumento en la eficiencia del corazón, porque el mayor volumen bombeado sólo requiere un pequeño aumento en el consumo de oxígeno. Lo único que se prolonga ligeramente en la fórmula es el tiempo de sístole, pero su efecto en el consumo de oxígeno es pequeño. En la insuficiencia mitral, por ejemplo, hay un aumento de la precarga, pero como no aumenta mucho el consumo de oxígeno, la aparición de insuficiencia cardiaca es más tardía.
Si la presión arterial y el VM se mantienen constantes, el aumento de la frecuencia cardiaca disminuye la eficiencia del corazón. Las taquicardias elevan el consumo de oxígeno sin aumentar, necesariamente, el trabajo que realiza el corazón (presión por volumen). Dado que cada latido necesita cierta cantidad de energía, se efectúe o no trabajo útil, hay un aumento del gasto energético y se reduce la eficiencia. El aumento de la frecuencia cardiaca puede incrementar el volumen cardiaco, pero a costa de una reducción de la eficiencia; esta situación puede ser bien tolerada si el aporte de flujo coronario es adecuado, pero en caso de estenosis de las arterias coronarias, el efecto del aumento en la frecuencia cardiaca es deletéreo.
El ejercicio físico, el estrés psíquico y todas las situaciones en las que están elevadas las catecolaminas circulantes incrementan la demanda de oxígeno, modificando varias de las variables mencionadas7. Es necesario destacar de todo lo mencionado anteriormente que la frecuencia cardiaca probablemente sea la variable más importante en la determinación de las demandas de oxígeno por el miocardio y, por tanto, su control adecuado debe ser un objetivo fundamental en el tratamiento de los pacientes con enfermedad isquémica
Determinantes del aporte de oxígeno al miocardio
Los principales factores que influyen en el aporte de oxígeno al miocardio son la capacidad de transporte de oxígeno de la sangre y el flujo coronario.
La capacidad de transporte de oxígeno por los hematíes se puede ver modificada por toda una serie de factores generales no relacionados con el corazón, tensión de oxígeno en el plasma, cantidad de hemoglobina y la capacidad de la hemoglobina para el transporte en relación con la concentración de 2,3-difosfoglicerato.
Flujo coronario
El corazón es el órgano que más oxígeno extrae de la sangre y trabaja en condiciones basales prácticamente al máximo de su capacidad extractora. Cualquier aumento en las necesidades de oxígeno del miocardio sólo puede ser satisfecho con un aumento paralelo en el aporte de flujo a través de las coronarias. En diástole, cuando se cierra la válvula aórtica los senos de Valsalva funcionan como reservorios y permiten la perfusión del miocardio. Las grandes arterias epicárdicas ofrecen muy poca resistencia al flujo y se comportan como vasos de conducción. De las arterias epicárdicas salen vasos que penetran la pared muscular, y en éstos y en las arteriolas se produce una caída de presión, por lo que son vasos de resistencia. La red de arteriolas es muy densa, con aproximadamente 4.000 capilares/mm2; los esfínteres precapilares permiten la regulación del flujo según las distintas necesidades. El flujo coronario depende de 4 variables: frecuencia cardiaca, diámetro y tono de las arterias coronarias, flujo por colaterales y presión de perfusión.
Frecuencia cardiaca
La perfusión coronaria se produce durante la diástole. Con el aumento de la frecuencia cardiaca se reduce especialmente el tiempo de llenado diastólico8.
Resistencia del árbol coronario
Como hemos comentado, las arterias epicárdicas ofrecen poca resistencia al flujo coronario, aunque pueden presentar vasoconstricción, con lo que aumenta la resistencia en respuesta a estímulos adrenérgicos de tipo alfa, y vasodilatación en respuesta a nitroglicerina9. Como en cualquier lecho vascular, el flujo coronario presenta una relación inversa con la resistencia del lecho coronario, en especial la del lecho capilar-arteriolar. La resistencia del árbol coronario está regulada por factores metabólicos, endoteliales o humorales, mecánicos, musculares y neurales, y además hay una autorregulación del flujo coronario.
El miocardio depende exclusivamente de un metabolismo aerobio; cualquier aumento en las necesidades de oxígeno debe ser compensado rápidamente con un aumento en el flujo y la reducción de las resistencias vasculares. Cuando se ocluye una arteria coronaria en el animal de experimentación, se provoca una hiperemia reactiva inmediata tras la apertura de la arteria10. La adenosina es el principal mediador en la respuesta vasodilatadora al aumento de las necesidades de oxígeno del miocardio. Se ha demostrado que la hipoxia juega un papel importante en la regulación del flujo coronario durante la hiperemia reactiva11. El óxido nítrico (NO) y los prostanoides son otros mediadores de la regulación metabólica del flujo coronario.
El endotelio vascular es capaz de producir factores vasoactivos que pueden modificar el tono de las arterias coronarias y, por tanto, el flujo coronario. El factor de relajación derivado del endotelio (EDRF) se genera en el endotelio intacto y es un potente vasodilatador; se ha identificado con el radical de NO12. El EDRF actúa en los vasos de conducción y en los de resistencia aumentado el flujo coronario. Además, el endotelio vascular es capaz de producir péptidos vasoconstrictores (endotelinas, en especial endotelina I) en respuesta a algunos estímulos, y se ha demostrado un aumento de su concentración en el infarto y la angina inestable.
En sístole hay compresión de los vasos intramiocárdicos y se reduce la perfusión; la mayor parte del flujo coronario ocurre durante la diástole. El deletéreo efecto de la sístole en la perfusión del miocardio se pone mucho más de manifiesto cuando la presión intraventricular está muy elevada en sístole, como ocurre en la estenosis aórtica. En ella el aumento de la frecuencia cardiaca aumenta el tiempo total de sístole por minuto, con compresión del lecho vascular y reducción del flujo, lo que unido al aumento de las demandas desencadena isquemia miocárdica. La limitación del flujo coronario por la compresión extravascular generada por el miocardio es más evidente cuando el tono vascular coronario está disminuido, como ocurre con el empleo de vasodilatadores13. En diástole hay flujo siempre que la presión de perfusión sea superior a la fuerza generada por la compresión del miocardio. Esta presión, conocida como presión a flujo cero, está alrededor de los 50 mmHg14.
Los vasos coronarios presentan una rica inervación simpática y parasimpática; la activación de estos sistemas ocasiona grandes cambios en el tono vascular coronario. El efecto directo de la estimulación de los receptores alfa 1 y alfa 2 de las arterias coronarias causa vasoconstricción; la estimulación de los receptores beta, vasodilatación.
Los cambios bruscos en la presión de perfusión del lecho coronario ocasionan un cambio del flujo transitorio porque se produce una autorregulación del flujo coronario. Se sabe que la autorregulación del flujo coronario está mediada por el EDRF (NO)15 y por la contracción de las fibras musculares arteriolares en respuesta al incremento de presión16.
Estenosis coronaria
La existencia de obstrucciones u oclusiones en las arterias epicárdicas reduce, como es obvio, el flujo coronario. Su limitación está relacionada con las características geométricas de la lesión, como longitud, grado de estenosis, distensibilidad y rigidez.
A causa de la estenosis se produce un gradiente de presión entre la porción proximal a ella y la distal; cuando aumenta mucho el flujo, el gradiente aumenta enormemente y la presión postestenótica se reduce. Todas las situaciones en las que aumente el flujo coronario son mal toleradas por los pacientes con estenosis fija, puesto que generan una caída de la presión de perfusión postestenótica.
Cuando el flujo se mantiene fijo, el factor determinante más importante es el grado de obstrucción. La caída de presión transestenótica es inversamente proporcional a la cuarta potencia del diámetro luminal mínimo. Un aumento en el grado de estenosis del 80 al 90% incrementa la resistencia al flujo en 3 veces17.
Colaterales
Cuando hay una oclusión total o subtotal de una arteria coronaria, el flujo puede llegar al miocardio por vasos colaterales. Las colaterales existen en todos los corazones como canales no funcionantes de 20 a 200 µ m. Cuando se produce una oclusión coronaria hay una caída en la presión distal a la oclusión que da lugar a la apertura de las colaterales18. Aunque la apertura de las colaterales es inmediata a la falta de flujo por oclusión, transcurre un período entre 3 semanas y 6 meses para su maduración.
El flujo recibido por las colaterales puede ser suficiente para evitar la isquemia en condiciones basales o de ejercicio ligero. Sin embargo, el flujo puede ser inferior al normal cuando se realizan esfuerzos importantes o se inyectan vasodilatadores18.
Presión de perfusión
Es el gradiente de presión entre la aorta y las arterias coronarias que, como hemos comentado, son vasos de conducción; por lo tanto, no hay gradiente alguno. El flujo va de epicardio a endocardio y en el endocardio la presión de perfusión depende de las diferencias de presión entre la presión diastólica aórtica y la presión telediastólica del ventrículo izquierdo. Buckberg et al19 demostraron en perros que el área comprendida entre las curvas de presión diastólica de la aorta y del ventrículo izquierdo representaba la presión de perfusión. Si dicha área se multiplica por el tiempo de perfusión (tiempo de diástole por frecuencia cardiaca), se obtiene un parámetro que traduce el aporte de flujo coronario. De igual modo, la demanda de flujo coronario es proporcional al área de la curva de presión en sístole. Por tanto, la relación entre estas dos áreas es una expresión hemodinámica de la relación entre la oferta y la demanda de flujo coronario.
Cualquier situación clínica que reduzca el flujo coronario puede ocasionar isquemia miocárdica. La causa más frecuente es la aterosclerosis con obstrucción coronaria, aunque puede haber otras afecciones o situaciones fisiológicas que desencadenen la isquemia por vasoconstricción. Por ejemplo, en relación con la ingestión puede producirse una vasoconstricción coronaria desencadenada por el estímulo del ácido en el esófago (reflejo cardioesofágico)20 o incluso después de la comida, en el caso de existir alguna estenosis, el flujo se puede redistribuir por vasconstricción de la arteria estenosada producida por las catecolaminas liberadas21. La reducción del flujo coronario suele ser multifactorial, pero quizá haya un factor que aparece en casi todas las situaciones, la taquicardia secundaria. El incremento de la frecuencia cardiaca con acortamiento de la diástole reduce el flujo y contribuye a aumentar un ya disminuido aporte de oxígeno al miocardio.
Consecuencias metabólicas de la isquemia miocárdica
En el miocardio isquémico se produce un cambio de metabolismo aerobio hacia anaerobio, acumulando lactatos y otros productos metabólicos que producen acidosis celular. La capacidad de generar energía por los miocitos (adenosintrifosfato [ATP] y fosfato de creatina) se reduce hasta el extremo y se agotan las reservas energéticas en un corto lapso22, sobre todo si tenemos en cuenta que durante el metabolismo anaerobio sólo se obtienen 3 moléculas de ATP por cada molécula de glucosa, en lugar de las 38 obtenidas en condiciones aerobias. La contracción cesa pronto por la falta de energía (ATP) y el desplazamiento de los iones de calcio de las miofibrillas por los radiales de hidrógeno generados en la acidosis. Los iones de potasio emigran al exterior de las células, con entrada de los iones de sodio, y se generan cambios en la diferencia de potencial transmembrana e inflamación del miocardio por acumulación intracelular de sodio23. El miocito intenta generar ATP por otras vías con la generación de moléculas de adenosinmonofosfato (AMP), que rápidamente son degradadas a adenosina. Esta molécula cruza al espacio extracelular por la membrana permeabilizada y estimula los receptores sensibles del miocardio, como veremos más adelante.
Como consecuencia del desequilibrio osmótico e iónico desencadenado por la isquemia en el miocito, se produce activación de proteasas y fosfolipasas, entrada descontrolada de calcio, desorganización estructural y muerte celular. Otros factores involucrados en la cascada de la isquemia son los oxirradicales y la endotelina I. Los primeros, metabolitos altamente reactivos al oxígeno, cuando se acumulan pueden contribuir a la lesión inducida por la reperfusión y la aparición de arritmias24. La concentración plasmática de endotelina I aumenta durante los episodios de isquemia, y se sabe que es un potente vasoconstrictor coronario y que aumenta la concentración de calcio citosólico, con lo que contribuye a la muerte celular25.
Miocardio aturdido
En 1935, Tennant y Wiggers demostraron que tras 60 s de oclusión coronaria la contracción del ventrículo se deteriora y vuelve a la normalidad de forma inmediata tras el restablecimiento del flujo. Durante décadas se pensó que la oclusión coronaria podía tener dos consecuencias: que no se restableciera el flujo, con depresión permanente de la contracción, o restablecimiento del flujo y recuperación precoz de la función contráctil, es decir, daño isquémico reversible. Heindrickx et al1 apuntaron una tercera posibilidad, la recuperación tardía de la contracción tras la isquemia severa, que fue bautizada por Braunwald et al2 como aturdimiento miocárdico.
El aturdimiento miocárdico es un fenómeno ampliamente extendido y con importantes repercusiones clínicas. Se ha demostrado que puede haber miocardio aturdido junto a miocardio necrótico (daño irreversible) tras la oclusión coronaria de varias horas seguida de reperfusión26; éste ha sido el argumento utilizado para justificar la apertura de la arteria en todos los pacientes tras el IAM (teoría de la arteria abierta). No es necesaria la oclusión total de una arteria, basta con que haya un aumento brusco de necesidades energéticas en presencia de una lesión para que pueda ocurrir el aturdimiento27.
Si conseguimos restablecer el equilibrio entre la oferta y la demanda de oxígeno del músculo cardiaco, el miocardio aturdido recuperará su función contráctil. Todos nuestros esfuerzos deben dirigirse, en primer lugar, al restablecimiento adecuado del flujo con la apertura de la arteria ocluida o la dilatación de la estenosis. En segundo lugar, y teniendo en cuenta el efecto deletéreo que supone la taquicardia, debemos utilizar fármacos que reduzcan y controlen la frecuencia cardiaca.
Miocardio hibernado
Fue definida en 1984 por Rahimtoola3 para describir una situación de función ventricular izquierda persistentemente deprimida en reposo como consecuencia de un flujo sanguíneo coronario reducido, que puede restaurarse parcial o completamente hasta la normalidad si la relación de aporte/demanda de oxígeno se ve alterada de forma favorable, mejorando el flujo sanguíneo y/o reduciendo la demanda. La hibernación sería un mecanismo de defensa del miocardio para proteger en cierto modo su viabilidad posterior. No se ha conseguido un modelo experimental reproducible sobre el miocardio hibernado, pero hay evidencias clínicas. Se ha comprobado la recuperación de la función contráctil en pacientes con miocardiopatía isquémica y disfunción grave del ventrículo izquierdo sometidos a revascularización coronaria.
Si modificamos los factores que alteran el desequilibrio entre aporte y demanda, conseguiremos recuperar la función ventricular del miocardio hibernado. En este sentido, los fármacos que reducen la frecuencia ventricular tienen un importante papel, pues aumentan el aporte (aumento de la diástole) y reducen la demanda (haciendo más eficiente al miocardio).
Preacondicionamiento isquémico del miocardio
Reimer et al22, en 1986, hicieron hallazgos sorprendentes al investigar el efecto de aplicar varios períodos de isquemia al corazón de perros anestesiados. Los períodos de isquemia y reperfusión cortos reducían la extensión de la necrosis que se provocaba posteriormente con un largo período de oclusión. Este fenómeno se conoce como preacondicionamiento isquémico. La correlación clínica de este fenómeno la tenemos en la menor extensión de los infartos de los pacientes que han presentado angina en las 2 semanas previas al episodio agudo.
Parece que durante los episodios de isquemia se activan los receptores de adenosina de la membrana, iniciando una cascada de eventos intracelulares que conducen a la fosforilación de una proteína de la membrana, que es la causa del efecto protector. La proteína que se fosforila es la del canal del potasio dependiente del ATP, que reduce la entrada de calcio, acorta el potencial de acción y reduce la contracción y ahorra energía en la fibra muscular28. La importancia del preacondicionamiento isquémico ha estimulado el interés por los fármacos que estimulan la apertura de estos canales de K dependientes de ATP.
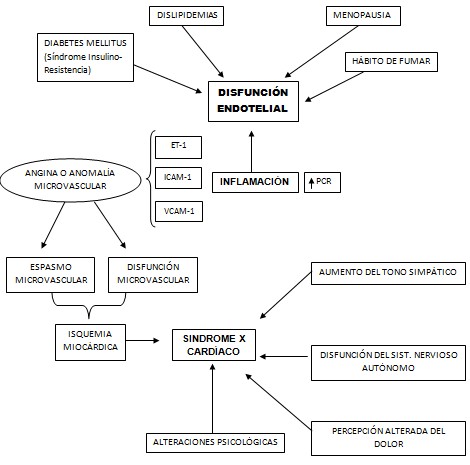
FISIOPATOLOGÍA DE LA ANGINA
El síntoma clínico de la isquemia miocárdica es el dolor precordial, la angina. La primera referencia clínica sobre la angina la hizo Séneca describiendo su propia enfermedad. En 1768, William Heberden presentó a 20 pacientes similares que aquejaban dolor retroesternal y en 1772 publicó sus observaciones en una revista de difusión médica. Heberden realizó una magistral descripción del proceso, que hemos leído en numerosas ocasiones. Sin embargo, reconoció su total desconocimiento sobre el origen del dolor y teorizó sobre las posibles causas: «No es fácil adivinar a qué corresponde este fenómeno. Yo no he podido averiguarlo. Quizá sea un fuerte calambre... La creencia de que se trata de un espasmo resulta razonable, si se considera la brusquedad del comienzo y la terminación, los largos intervalos de bienestar, el alivio que proporcionan el vino y las bebidas espirituosas, la influencia que las preocupaciones tienen en él... y, por último, la característica de presentarse en ciertos sujetos por la noche después del primer sueño, precisamente en el momento en que aparecen las pesadillas... y otros procesos que se atribuye a la función nerviosa».
Tenemos que reconocer que después de más de 300 años, el mecanismo íntimo que produce la angina es complejo y aún no está del todo definido. Un hecho está claro: la isquemia reduce la formación celular de ATP, con acidosis y salida de una serie de sustratos que estimulan quimiorreceptores y mecanorreceptores de terminaciones nerviosas desmielinizadas existentes entre las fibras musculares del miocardio y los vasos29. Entre las sustancias liberadas, se ha demostrado la histamina, la adenosina, el lactato, la serotonina, la bradiquinina y los radicales libres de oxígeno.
Está demostrado que el mediador primario de la isquemia es la adenosina, vía estimulación del receptor A1 de la adenosina. Es posible que la venodilatación inducida por la isquemia pueda activar también estos receptores.
Los estímulos dolorosos son conducidos por fibras nerviosas simpáticas hasta los ganglios simpáticos situados entre C7 y T4, y desde allí hasta el tálamo y la corteza cerebral. La angina, como sensación, es referida a los mismos desmosomas que transmiten sus estímulos por las mismas regiones de la espina raquídea. Se ha comprobado que los estímulos originados en distintos receptores sensitivos cardiacos utilizan las mismas vías de subida hacia la corteza cerebral que dichos desmosomas. Las especiales características clínicas de la angina, su distribución difusa (precordial, cuello, brazos) y que cada paciente siempre refiera el dolor en la misma localización (independiente de la zona de isquemia) están en relación con estas vías de transmisión.
CONCLUSIONES
La isquemia miocárdica es una entidad multifactorial en la que hay un desequilibrio entre la oferta y la demanda de energía por el miocardio. El efecto de la isquemia es la pérdida de la capacidad de contracción de la fibra muscular, pero en la actualidad sabemos que este daño puede ser reversible y que incluso en caso de necrosis establecida existen grupos musculares con capacidad de contracción si se restablece el aporte de sangre. La taquicardia tiene un importante papel en la aparición de la isquemia, pues afecta de forma inadecuada a los dos brazos de la balanza, la demanda y el aporte. Los fármacos que reducen la frecuencia cardiaca deberían utilizarse siempre en todas las situaciones en que hay isquemia miocárdica.