lunes, 21 de mayo de 2012
Nuevos paradigmas en Congestión
Síntomas
Viejo paradigma: “En un paciente con insuficiencia cardíaca descompensada los síntomas son el mayor
problema de la congestión”
Nuevo paradigma: La incapacidad de regular el estado de volumen es la mayor consecuencia de la falla cardíaca aguda. Una variedad de procesos fisiopatológicos contribuye a este daño, siendo los más destacados la activación neurohormonal del sistema renina-angiotensina-aldosterona (SRAA), vasopresina-arginina, y sistema nervioso simpático. La activación neurohormonal lleva a cambios sustanciales en la hemodinamia y en la remodelación cardíaca, contribuyendo a la mayor severidad de la insuficiencia cardíaca. La presión capilar pulmonar es un reflejo del estado del volumen.
Grandes estudios clínicos y recientes registros han demostrado que la mayoría de las hospitalizaciones por
insuficiencia cardíaca ocurren por congestión más que por bajo gasto. Si bien sabemos que la congestión es
un mecanismo compensador en respuesta a un deterioro cardíaco, datos recientes sugieren que en realidad el incremento de las presiones de llenado ventricular izquierdo (VI) contribuye a la progresión de la falla cardíaca.
Las presiones elevadas de fin de diástole del VI aumentan el estrés parietal, cambian la geometría ventricular, alteran el drenaje venoso hacia venas coronarias y aurícula derecha, contribuyendo al empeoramiento de la función diastólica; reposicionan los músculos papilares, generando insuficiencia mitral (IM) funcional, y causan isquemia subendocardíca, llevando a la muerte celular por apoptosis o necrosis.
Un importante número de estudios demostró que pacientes con insuficiencia cardíaca (IC) elevan el dosaje de
troponina en sangre, independientemente de la presencia de enfermedad arterial coronaria, indicando la existencia de injuria miocárdica por otros mecanismos distintos a la enfermedad coronaria. Resulta interesante la evidencia de haberse encontraron niveles anormales de troponina T en un 50% de pacientes ambulatorios con IC avanzada.
La presencia de congestión (presiones de llenado elevadas) podría resultar particularmente deletérea en pacientes con ICA, hipotensos con enfermedad arterial coronaria (miocardio hibernado) o sin ella. En este escenario de injuria, consecuencia de activación neurohormonal, sobrecarga hemodinámica y/o isquemia, el miocardio desciende su capacidad contráctil en un intento de ahorrar energía a fin de preservar la sobrevida de los miocitos, es decir, es un miocardio viable, no contráctil que define un área vulnerable, en potencial riesgo de morir ante cualquier nuevo evento de descompensación cardíaca, creando de este modo una “tormenta perfecta” que lleva a la injuria miocárdica y a la falla cardíaca progresiva.
Lo interesante de los conceptos expuestos es entender que la congestión clínica en realidad es sólo la punta de un iceberg, es un elemento tardío, ya que todos los procesos descriptos como disparadores de muerte celular ocurren mucho antes de que estas alteraciones generen síntomas congestivos de IC.
La posibilidad de utilizar dispositivos de monitoreo hemodinámico ambulatorio continuo resulta de gran interés. Estos dispositivos implantables, en sus diferentes posibilidades tecnológicas, brindarían información hemodinámica precoz para el ajuste de la terapia ambulatoria, reduciendo de este modo la necesidad de hospitalización, evitando exacerbaciones del síndrome, congestión, isquemia y muerte celular.
Síndrome cardio-renal
Viejo paradigma: “El empeoramiento de función renal en la IC descompensada se atribuye, ya sea, a una hipoperfusión del riñón secundaria a un empeoramiento progresivo del gasto cardíaco o a una depleción del
volumen intracelular producto del uso y abuso de la terapia diurética”
Nuevo paradigma: Es de notar que la mayoría de los pacientes hospitalizados con ICA presentan congestión
central o periférica. Datos experimentales han demostrado que la elevación aislada y transitoria de la presión venosa central (PVC) puede trasmitirse en forma retrógrada a las venas renales, resultando en un empeoramiento directo de la función renal. En modelos experimentales en los que iatrogénicamente se indujo hipervolemia, el incremento de la PVC llevó a una insuficiencia renal (IR) en forma directa, independiente del gasto cardíaco (GC) o del flujo sanguíneo renal. El mecanismo es el incremento de la PVC que se transmite en forma retrógrada al riñón, vía vena renal, con aumento de la presión intersticial renal y subsiguiente disminución en la excreción de sodio y agua.
Como compensación, se libera mayor angiotensina II (Ang II), produciendo vasoconstricción de la arteriola eferente a fin de preservar la tasa de filtrado glomerular (FG); pero también, tiene efectos colaterales al actuar sobre el túbulo proximal, provocando aumento de la reabsorción de sodio, incremento de la presión arterial sistémica, aumento de la postcarga, reducción del volumen minuto (VM), y como
consecuencia, reducción de la perfusión renal. Este fenómeno demostró ser reversible, ya que descendiendo
las presiones venosas renales, inmediatamente, mejora el VM urinario y el FG. Otros estudios demuestran que la compresión temporaria de la vena renal resulta en una disminución en la excreción de sodio, reducción del FG y del flujo sanguíneo renal. El aumento de la PVC también causa un incremento de la presión intersticial renal, la cual podría llevar a un estado de hipoxia del parénquima, similar al mecanismo por el cual la congestión hepática lleva a una disfunción del hígado en la IC.Recientes publicaciones demostraron que en pacientes con IC descompensada y bajo GC, el principal determinante hemodinámico relacionado con el empeoramiento de la función renal no fue como se pensaría el grado de compromiso de función ventricular, sino la presencia de insuficiencia renal intrínseca y la congestión venosa, tanto el incremento de la PVC en la admisión, como su insuficiente reducción durante la hospitalización. Estas
confirmaciones clínicas validan conceptos experimentales previos en los cuales la preservación de la función cardíaca sin calmar la congestión venosa no podría, por si sola, evitar el desarrollo de una IR.
La intervención neurohormonal detallada anteriormente, demuestra que la disfunción renal en la IC no se explica exclusivamente por alteraciones hemodinámicas, o sea por bajo GC. De hecho, existe entre un 37% y un 55% de pacientes con IC que tienen fracción de eyección del ventrículo izquierdo (FEVI) > 45% y presentan falla renal. En la fisiopatología de este proceso, intervienen en forma compleja el SRAA, el balance óxido nítrico/especies reactivas de oxígeno (ROS), la inflamación y el sistema nervioso simpático. Todas estas variables estarían interrelacionadas y serían responsables de la aterosclerosis acelerada, de la remodelación, de la hipertrofia ventricular izquierda y de la progresión de la enfermedad renal (teoría de la conexión cardiorrenal).
Resulta pues de suma importancia, el descenso juicioso y prudente de las presiones de llenado a fin de mejorar o evitar la falla renal asociada a una IC descompensada. En este intento, debemos evitar la hipoperfusión y la azoemia prerrenal. El uso del cateterismo derecho en un paciente seleccionado, como guía para el descenso de la presión capilar pulmonar (PCP) y de la PVC podría ser de suma utilidad. El estudio ESCAPE demostró que esta guía hemodinámica evita el empeoramiento renal, comparada con aquellos pacientes en donde la terapia fue guiada por criterios clínicos.
El concepto de “falla renal congestiva” es de gran valor clínico, ya que desplaza al deterioro de la función cardíaca como único protagonista del problema.
Correlación clínica/hemodinamia
Viejo paradigma: “En pacientes con insuficiencia cardíaca los síntomas se correlacionan con la clínica y ésta
con la hemodinámica”
Nuevo paradigma: El Registro ADHERE (A Report from the Acute Decompensated Heart Failure National Registry) considera, desde un punto de vista fisiopatológico, que hay dos poblaciones muy diferentes de pacientes según la forma de presentación clínica en el momento del ingreso hospitalario: 1) los vasculares, y 2) los miocárdicos. Ambos grupos comparten una clínica común: el patrón congestivo, es decir presiones de llenado ventricular elevadas; y se diferencian por el tipo de disfunción ventricular presente: los vasculares con función sistólica preservada y los miocárdicos con alteraciones
de la misma. Analizaremos el grupo falla miocárdica, representado en la población de pacientes con IC crónica descompensada. Esta población incluye a pacientes con presión arterial normal o baja, empeoramiento gradual de los síntomas (días), retención hídrica, congestión sistémica más que pulmonar y PCP crónicamente elevada. En ellos, los estertores pulmonares pueden faltar y en la radiografía
de tórax apreciarse una congestión leve o ausencia de la misma. Presentar un aumento del peso corporal e importantes edemas periféricos. La FEVI es menor del 40%. El comportamiento de las resistencias vasculares sistémicas (RVS) es variable y puede presentar valores normales o bajos. La respuesta al tratamiento suele ser parcial, persistiendo la congestión sistémica a pesar de la respuesta
sintomática inicial. En esta población de pacientes, la mayoría de las veces, están elevadas las presiones de
llenado; sin embargo en mucho de ellos, la congestión clínica es silente, no siendo reconocida hasta generar una hospitalización. Este escenario podría denominarse “congestión hemodinámica” (etapa preclínica) en oposición a la “congestión clínica” que es más tardía y evidenciada por signos y síntomas de congestión cardiopulmonar y/o sistémica. La resolución clínica puede ocurrir con persistencia de la congestión hemodinámica.
En general, la combinación de signos y síntomas clínicos, no sólo es tardía, sino que en el caso de los signos posee solamente un 58% de sensibilidad para detectar presiones de llenado elevadas.
La dificultad para reconocer clínicamente el verdadero estado hemodinámico de un paciente con IC crónica
descompensada, estimula la idea de realizar un cateterismo derecho y en caso de detectar PCP elevada, una
eventual “terapia de ajuste” tratando de reducir dichas presiones a valores hemodinámicos lo más próximos a lo normal. Este descenso de la PCP demostró un impacto pronóstico favorable en este tipo de pacientes. No sólo es una cuestión de mejoría sintomática. Tenemos fuerte evidencia de que la reducción a valores de 15-18 mm Hg es capaz de mejorar el GC, debido fundamentalmente a la reducción de la regurgitación mitral (insuficiencia mitral funcional), pero también puede reflejar menor tensión de pared con descenso del consumo miocárdico de oxígeno y mejor perfusión coronaria. También se relaciona esta intervención hemodinámica como una reducción directa e inmediata de la activación neurohormonal, mejorando
la vasodilatación periférica al ejercicio e incrementando la performance al ejercicio.
Estos conceptos avalan la idea que debemos orientar nuestros esfuerzos terapéuticos a tratar la congestión y no sólo a buscar la tradicional mejoría del GC.El estudio ESCAPE (Evaluation Study of Congestive
Heart Failure and Pulmonary Artery Catheterization)comparó el manejo terapéutico guiado por variables clínicas con el manejo guiado por monitoreo hemodinámico (MH). A pesar del entusiasmo inicial con este manejo invasivo, el ESCAPE no observó diferencias significativas en los puntos finales de muerte y hospitalización a los 6 meses de seguimiento. Actualmente, el cateterismo derecho no es una indicación rutinaria en el manejo de pacientes con falla cardíaca aguda. Resulta, sin embargo interesante, que a pesar de la falta de beneficio del grupo con MH en este estudio, la colocación del catéter de SwanGanz no se acompañó de mayor mortalidad. Podríamos decir que la participación de centros especializados en IC,
como fue en el ESCAPE, explicaría la baja incidencia de complicaciones relacionadas a la colocación del catéter en los grupos estudiados. De este modo, los pacientes con IC crónica descompensada podrían beneficiarse del MH, ya que no registrarían aumento de la mortalidad por este procedimiento y sí mejoría de sus síntomas. El objetivo de mejorar la calidad de vida (síntomas) es muy preciado en pacientes portadores de IC.
El paradigma “correlación clínica/hemodinámica” no es real como se piensa o desea. La mayoría de las veces nos enfrentamos a un verdadero desafío clínico. La ayuda del cateterismo derecho, a pesar de lo expuesto, no debería a nuestro criterio ser descartado; entendiendo que el éxito de su colocación e interpretación dependerá del equipo médico entrenado en este tipo de procedimientos. Tal vez
debamos aceptar que no es el conocimiento y manejo de las variables hemodinámicas lo que no resulta útil; sino que aún no sabemos cómo interpretar y manejar esta valiosa información hemodinámica.
Fisiopatología: la acumulación de líquido
Viejo paradigma: “La fisiopatología de la falla cardíaca aguda es todo acumulación de líquido”
Nuevo paradigma: Tradicionalmente, el paradigma indica que la falla cardíaca es causada ya sea por un deterioro agudo o crónico de la contractilidad ventricular y de la acumulación progresiva de fluidos.
El conocimiento de que los eventos hemodinámicos pudieran preceder a una IC aguda es limitado por el uso selectivo del cateterismo derecho. En el registro ADHERE, la principal observación hemodinámica se refiere a que la ICA podría ser iniciada por una crisis de hipertensión arterial (HTA). En el mencionado estudio, la presión arterial sistólica (PAS) promedio al ingreso hospitalario fue de 143 mm Hg, indicando que un incremento en la RVS podría ser un importante disparador de la descompensación.Esta “falla vascular” sería el resultado de un incrementode la RVS sobre una contractilidad cardíaca descendida (a pesar que en muchos casos la FE puede estar relativamente preservada). Este mismatch entre un rápido incremento de la postcarga y un empeoramiento de la función ventricular, resulta en un aumento de la presión de fin de
diástole del VI y un descenso del GC. Esto explica la presencia de congestión pulmonar a pesar de la acumulación modesta de fluidos, llevando a una redistribución de éstos desde la circulación periférica a la pulmonar, debido a un incremento de la presión venosa pulmonar transferida en forma retrógrada a los alveolos. El mecanismo exacto de este aumento de RVS no es claro, pudiendo explicarse por varios mecanismos desde un aumento de la rigidez arterial hasta una activación inflamatoria.
Una posible “endotelitis aguda” (interacción de disfunción endotelial y sobrecarga de fluidos) a punto de partida de un insulto inflamatorio (estímulos bioquímicos y/o biomecánicos) podría explicar el inicio o empeoramiento de una “endotelitis sistémica” caracterizada por el incremento del estrés oxidativo y la disfunción endotelial, que favorecería una centralización del volumen sanguíneo, fundamentalmente, por constricción de venas de capacitancias (visión vasculocéntrica como complemento de la cardiocéntrica). La congestión resultante genera mayor congestión por distintos mecanismos, llevando a un círculo vicioso con
progresivo empeoramiento vascular, cardíaco y renal.
Es todo un interrogante determinar si la inflamación que acompaña a una ICA es el resultado, o más bien la causa, de esa descompensación. Algunos investigadores especulan que el ascenso de la proteína C reactiva (PCR), como reactante de faz aguda y marcador inespecífico de inflamación, podría ser en el contexto de una descompensación cardíaca, secundaria a isquemia mesentérica. En este caso, el estado
inflamatorio sería el resultado de la traslocación bacteriana o de endotoxinas desde el intestino al torrente circulatorio. En estos pacientes, el ascenso de la PCR sería un predictor independiente de mortalidad a largo plazo. Visto de este modo, la inflamación podría ser el resultado de la descompensación y no su gatillo inicial.Otros autores atribuyen a la inflamación por sí misma como el origen de la descompensación cardíaca. La presencia de citoquinas proinflamatorias actuaría en la descompensación y en la progresión de la IC a largo término. El aumento de estos marcadores inflamatorios podría modificar el fenotipo de la falla cardíaca incrementando la rigidez diastólica, la disfunción ventricular, la permeabilidad capilar y el edema
de pulmón. Esta hipótesis está respaldada por hallazgos de Milo y colaboradores, quienes en el seguimiento alejado a 2 meses de pacientes con falla cardíaca aguda sin antecedentes de isquemia, arritmia o enfermedad valvular previa, encontraron niveles elevados de IL6 y PCR. Estos datos apoyan la idea de una “falla cardíaca aguda inflamatoria” como un verdadero “subtipo de falla cardíaca aguda” y no relacionada a la existencia de una falla cardíaca crónica.
Estos nuevos conceptos centran el inicio de la descompensación cardíaca en la periferia, verdaderas fallas vasculares. Independientemente del disparador de este aumento de RVS, el resultado final es un desajuste entre la postcarga y la contractilidad, con una redistribución más que una acumulación de fluidos, determinando en este grupo de pacientes un manejo terapéutico a predominio de drogas vasodilatadoras sobre los tradicionales diuréticos.La importancia de este nuevo concepto fisiopatológico, basado en un verdadero desorden vascular como disparador de la descompensación, se podría reflejar en las recientes
publicaciones sobre “potencia cardíaca”, índice que resulta del producto (medido simultáneamente) entre el GC y la presión arterial media (Cpi = GC x PAM) y su relación con las RVS, pudiendo resultar de suma importancia como marcador diagnóstico, estratificador de riesgo y potencial método de monitoreo, tanto de pacientes con IC crónica como aguda.
Conclusión
Sin duda, la congestión no sólo es el reflejo del fracaso del músculo cardíaco; sino que, como comentamos, las presiones de llenado elevadas favorecen la progresión de la IC y la muerte celular.
Creer que sólo estamos “calmando síntomas” al tratar a un paciente congestivo, es una idea muy simplista, ya que a la fecha tenemos evidencia de que la intervención terapéutica a fin de descender la PCP elevada, cambia el pronóstico, modificando no sólo la calidad sino la cantidad de vida en los pacientes con IC avanzada, incluso con un mayor impacto que la mejoría del índice cardíaco. La dificultad para
diagnosticar y tratar adecuadamente a nuestros pacientes congestivos se ve reflejada en la frecuente disociación: síntoma-clínica-hemodinamia. Esta dificultad observada tanto en pacientes hospitalizados como en los atendidos por departamentos de IC, atenta contra el músculo cardíaco viable en riesgo potencial de muerte (miocardio vulnerable) propio de la ICA.La importancia del impacto sistémico de patrones congestivos también se ve reflejado por la evidencia clínica de daño de órganos blancos que hasta no hace mucho era un escenario exclusivo del bajo gasto cardíaco.La interpretación de nuevos conceptos fisiopatológicos en los cuadros de ICA nos explica como la resistencia vascular sistémica comienza a jugar un rol fundamental en la iniciación de cuadros vasculares y congestivos. La función cardíaca pareciera desplazada a un segundo plano, dado que estas formas de presentación clínica cursan en su mayoría
con FE preservada.Conceptos hemodinámicos, neurohormonales e inflamatorios convergen para ampliar aún más este panorama en donde una endotelitis sistémica, producto de gatillos inflamatorios, elevaría inicialmente la resistencia vascular sistémica, generando secundariamente un mismatch ventrículo-arterial que llevaría a cuadros de edema agudo de pulmón.
Es evidente que debemos modificar nuestro pensamiento basado en “viejos paradigmas de temas congestivos” que se fundan en tradicionales conceptos fisiopatológicos, y de esta manera ampliar nuevos horizontes sobre el campo diagnóstico y terapéutico de la IC aguda.
domingo, 20 de mayo de 2012
MUERTE SUBITA EN DEPORTISTAS
Se tiene conocimiento de la Muerte Súbita relacionada con actividad física, desde el año 490 a. C. cuando el soldado griego Pheidippides murió al llegar a Atenas, después de haber corrido desde Maratón. La Muerte Súbita, constituye un suceso muy dramático, ya que involucra el fallecimiento de una persona activa y en la mayoría de los casos, en plena juventud.
Inicialmente fue tomado el término, para designar aquellos fallecimientos súbitos e inexplicables, simbolizados por la inocencia de la comunidad médica; en el atleta, se define como aquel deceso inesperado, no violento ni traumático, que se presenta instantáneamente o dentro de la primera hora de haberse iniciado los síntomas cuando se está realizando actividad física deportiva o inmediatamente después. Algunos autores prolongan el tiempo de evolución del cuadro hasta 6 horas después de haberse iniciado.
I. Presentación y frecuencia
La Muerte Súbita en población general, se presenta alrededor de 400,000 casos anualmente en los Estados Unidos . La presencia de este evento en el atleta es afortunadamente, poco frecuente y de acuerdo a las estadísticas reportadas, y tomando en cuenta los grupos estudiados, podemos concluir que en los Estados Unidos se observan 100 casos de muerte súbita durante ejercicio en atletas por año; con 25 millones de participantes en deportes competitivos en esa nación, corresponde entonces a 4 muertes por millón de atletas por año. En los estudiantes a nivel bachillerato, se tiene estimado que ocurra con un rango de 1:100,000 a 1:300,000 por año académico . En actividad física de forma recreativa, se tienen reportes de que se presenta una muerte por cada 887,526 horas de participación en actividades físicas; en otro estudio, en Rhode Island, entre corredores recreativos masculinos entre 30 a 64 años de edad, se observó un fallecimiento por cada 396,000 horas, o una por cada 7,620 corredores por año. En lo que se refiere a los corredores de maratón, se tiene estimado que existe de una a dos muertes anualmente en una población de 15,000 a 25,000 sujetos de esta disciplina . Se tiene el reporte de esquiadores y caminata en montaña en Austria y se observa una muerte súbita por cada 780,000 horas de caminata y 1'630,000 horas de esquiar . En cuanto al género, podemos decir que en los hombres es más frecuente que en las mujeres a razón de 0.75 y 0.13/100,000, respectivamente.
II. Clasificación
De acuerdo al mecanismo etiológico, la muerte súbita se puede clasificar de la siguiente manera :
Certera: aquellos casos en los cuales, durante la necropsia se identifique una evidencia anatómica obvia como su causa; por ejemplo un infarto al miocardio agudo o ruptura de aorta.
Probable: en los sujetos en los cuales se encuentra un cambio anatómico que pudiera causar alteraciones secundarias, tales como la Hipertrofia concéntrica del ventrículo izquierdo o la Arteriopatía coronaria.
Presumible: Aquellos casos en los cuales no se identifica una causa que directamente este involucrando a la muerte súbita; por ejemplo, Prolapso de la válvula mitral.
Existe otra forma de clasificar a los sujetos que presentan muerte súbita, y es de acuerdo a la edad de presentación; a saber, se divide en dos grandes grupos: a) menores de 35 años, y b) mayores de 35 años. Lo anterior es debido a que la frecuencia de patologías causantes es diferente. En el primer grupo, las enfermedades cardíacas congénitas constituyen la mayor proporción de causa de muerte, mientras que en el segundo grupo, la enfermedad coronaria ateroesclerótica es la principal etiología . Hay que tomar en cuenta que en la población general, el 80% de las muertes súbitas son atribuibles a una arritmia cardíaca, la cual puede ser causada por variados sustratos etiológicos .
III. Causas en menores de 35 años
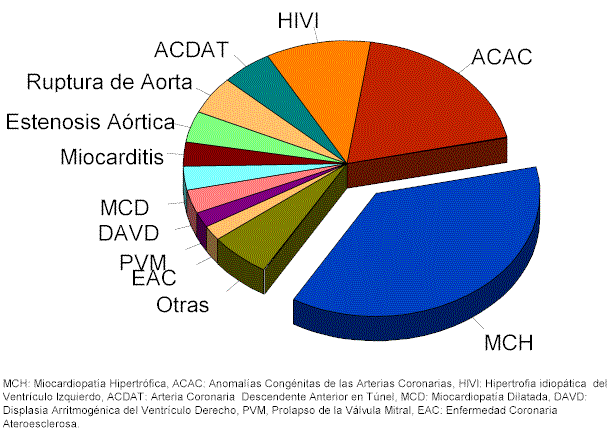
Como ya se mencionó, las enfermedades cardíacas congénitas, son la causa principal de muerte súbita en menores de 35 años, siendo la Miocardiopatía hipertrófica asimétrica la que con mayor frecuencia es observada en dichos sujetos. También se encuentran otras patologías como: Displasia arritmogénica del ventrículo derecho, anomalías coronarias congénitas, Hipertrofia idiopática del ventrículo izquierdo, entre otras (Cuadro I).
a) Miocardiopatía hipertrófica
La Miocardiopatía hipertrófica es una enfermedad caracterizada por la alteración idiopática del miocardio que incluye la presencia de hipertrofia ventricular izquierda y/o derecha en ausencia de una causa cardíaca o sistémica, y que suele predominar la afectación sobre el tabique interventricular . La enfermedad es frecuentemente familiar y se caracteriza por la desorganización de miocitos y miofibrillas, el aumento de la matriz colágena y las alteraciones de las arterias coronarias intramiocárdicas. Algunos pacientes presentan gradientes intraventriculares y son frecuentes las alteraciones de la función diastólica ventricular, la isquemia miocárdica y las arritmias . Recientemente se han identificado mutación de nuevos genes causantes de la enfermedad, aparte de las ya encontradas en la cadena pesada de la - miosina (14ql), están las de tropomiosina (15q2), en el gen de la troponina T cardíaca (1q3), así como en el locus 11 p13-q13 .
Clínicamente puede cursar asintomática o manifestarse por disnea, angina, síncope y muerte súbita. En el 47% de los pacientes, cursa asintomática antes de presentarse muerte súbita, y sólo el 7% presentan síncope previamente . En algunos casos, la enfermedad progresa hacia el deterioro de la función sistólica e insuficiencia cardíaca.
En un inicio, la Miocardiopatía hipertrófica era reconocida solo por sus características hemodinámicas, especialmente el gradiente en el tracto de salida ventricular izquierdo; sin embargo, el espectro de la enfermedad se ha ido ampliando con la identificación principal de dos formas de presentación: la obstructiva (de la eyección del ventrículo izquierdo) y la no obstructiva caracterizada principalmente por disfunción diastólica del mismo ventrículo . La peor manifestación de la Miocardiopatía hipertrófica es la muerte súbita la cual es la principal causa de muerte condicionando más de la mitad de la mortalidad de estos pacientes, con una incidencia anual del 2-4% en adultos y del 4-6% en niños y adolescentes . Cuando se trata de la muerte súbita en atletas, la Miocardiopatía hipertrófica es causa en el 36%. Se identifican ciertos factores de riesgo para muerte súbita, en los que se encuentran: I) la edad, pues el riesgo de muerte súbita es significativamente mayor en niños y jóvenes, disminuyendo en etapas posteriores de la vida; II) así mismo, la historia familiar con miocardiopatía hipertrófica presenta una alta incidencia de muerte súbita precoz. No existe correlación entre el grado sintomático de los pacientes y el riesgo de muerte súbita, únicamente el síncope recurrente parece tener significado en niños y jóvenes con miocardiopatía hipertrófica . En algunos estudios se ha identificado el ejercicio como factor desencadenante de muerte súbita por diferentes mecanismos: I)aumento del tono adrenérgico, con mayor "obstrucción" del ventrículo izquierdo; II)taquicardia y vasodilatación periférica, con mayor dificultad al llenado diastólico, y III)inestabilidad eléctrica; es importante recalcar que la mitad de las muerte súbitas en atletas jóvenes se deben a la Miocardiopatía hipertrófica. Como consecuencia de estudios realizados en pacientes con Miocardiopatía hipertrófica considerados como de alto riesgo, se han podido identificar varios mecanismos potenciales que solos o combinados, pueden dar lugar a muerte súbita; estos mecanismos no son los mismos en todos los pacientes y probablemente son diferentes en niños y en adultos. Así mismo, algunos pueden tener una base hemodinámica mientras otros son arrítmicos. Entre los diferentes mecanismos que se han propuesto están: a)arritmias ventriculares, b)arritmias supraventriculares (como la fibrilación auricular) causantes de colapso cardíaco, c)bradicardias, d)isquemia severa (debida en parte a la escasa reserva coronaria secundaria a las alteraciones en los pequeños vasos coronarios intramiocárdicos), e)conducción aurículo-ventricular rápida (debida a la presencia de vías accesorias o no) y trastornos de la conducción. Por otra parte, en el estudio de Yoshida y cols., proponen una relación entre los cambios electrocardiográficos sugestivos de isquemia subendocárdica durante el ejercicio y una respuesta anormal en la presión arterial, también durante la actividad física.
Las consecuencias hemodinámicas de estas anomalías electrofisiológicas pueden verse aumentadas por la presencia de obstrucción subaórtica, alteraciones de la función diastólica, por la respuesta a una arritmia ó a la propia taquicardia sinusal fisiológica que puede estar modulada por la anormal respuesta vascular periférica identificada en un 30-40% de los pacientes jóvenes, que presentan hipotensión de esfuerzo a pesar de aumentar normalmente el gasto cardíaco . Además de los factores hemodinámicos, la inestabilidad eléctrica del miocardio es un determinante importante de muerte súbita, esto influenciado probablemente por el grado de desorganización de las fibras miocárdicas. Frecuentemente existen además, anormalidades en las coronarias intramurales hasta en el 80% de los casos estudiados en necropsias. Las arterias tienen engrosadas las paredes (por aumento de la íntima y de la media) y su luz está reducida, siendo ésto, en grandes zonas miocárdicas. Se han podido identificar algunas alteraciones electrocardiográficas en este tipo de pacientes, tales como datos de crecimiento ventricular izquierdo, alteraciones de la repolarización con ondas T isoeléctricas, PR corto, arritmias ventriculares y supraventriculares.
Existe una gran relación entre la actividad física y muerte súbita en los sujetos que padecen cardiomiopatía hipertrófica . Por lo anterior, se debe de diagnosticar en forma oportuna esta enfermedad y poder prevenir la muerte, limitando los riesgos de acuerdo a los lineamientos propuestos por la 26ª Conferencia de Bethesda .
b) Anomalías congénitas de las arterias coronarias
En lo que se refiere a las anomalías congénitas de las arterias coronarias, que constituyen la segunda causa en frecuencia de muerte súbita en atletas menores de 35 años, dichas anomalías pueden ser en su origen así como en su trayecto (cuadro II), además de que encontrar esta enfermedad in vivo, es desafortunadamente raro, ya que de lo contrario, podríamos actuar en consecuencia para prevenir la muerte . Se presenta con una frecuencia de 0.2 a 1.4% de la población sometida a coronariografía , pero en estudios de necropsia general se aprecia con un aumento hasta del 2.2%, con más alta frecuencia en hombres, encontrándose en un 81%. Es causante de muerte súbita en deportista con un porcentaje variable; puede ser según reportes que hablan desde el 12 al 14%, hasta un 19% de acuerdo como lo reporta Maron . De los casos con anomalías de la coronaria izquierda, el 57% presenta muerte súbita, en contraste con las anomalías de la coronaria derecha que solamente el 25% presentan muerte inesperada .
La anomalía más frecuentemente observada en este grupo de patologías, es el origen de la coronaria izquierda y derecha a partir del seno de Valsalva derecho . Existen otras formas de presentación enlistadas en el cuadro I, en donde también se observan como causas de muerte súbita, las arterias coronarias en túnel, las hipoplásicas y las que se encuentran con fístulas . En un estudio de Steinberg se presentó una asociación de las anormalidades de las coronarias con la miocardiopatía hipertrófica en un 16%, en personas de 1-21 años de edad, que murieron súbitamente.
Aunque no se ha identificado totalmente el mecanismo de muerte súbita en los deportistas que presentan este tipo de anormalidades coronarias, se ha propuesto varias teorías: I) compresión de la coronaria entre la aorta y el tronco de la arteria pulmonar, II) el acodamiento de la coronaria, y III) espasmo arterial, llevando todo lo anterior a la presentación de arritmias ventriculares secundarias a isquemia miocárdica aguda .
c) Hipertrofia idiopática del ventrículo izquierdo
La hipertrofia idiopática del ventrículo izquierdo es la tercera causa de muerte súbita dentro de los deportistas y se identifica por presentar un exagerado crecimiento de las paredes ventriculares, teniendo una hipertrofia concéntrica con disminución de la cavidad ventricular, en forma simétrica . Ésta, puede ser una variante de la miocardiopatía hipertrófica, y en algunas ocasiones se le ha asociado a una hipertensión no diagnosticada previamente . En un estudio realizado por Maron y cols. , en atletas que murieron súbitamente, encontraron una frecuencia de presentación del 10%, que se asemeja a lo reportado por Maron y la Asociación Americana de Corazón, aunque existen reportes desde el 3.2% de frecuencia como causa de muerte súbita en atletas , hasta el 18%, reportado por Salem. Hay que hacer diferencia de la hipertrofia encontrada como una adaptación al ejercicio , y la observada en esta forma de patología; aunque la originada por actividad física también es importante por las dimensiones que puede alcanzar, el grado de hipertrofia encontrada en la idiopática, es hasta de 600gr, superando lo previsible por un alto nivel de entrenamiento. De igual manera, Maron relaciona diversos criterios para distinguir entre la hipertrofia encontrada en el "corazón del atleta" y en la miocardiopatía hipertrófica, en donde valora los patrones inusuales de hipertrofia ventricular izquierda, dimensión de la cavidad ventricular izquierda, patrones electrocardiográficos, dimensión de la aurícula izquierda, género femenino, disminución de la hipertrofia con el desacondicionamiento y la historia familiar de la miocardiopatía hipertrófica, dejando una "zona gris" entre los dos grandes grupos, constituyendo un círculo de riesgo aumentado para poder definir entre lo patológico y lo fisiológico. Típicamente, presentan un grosor del séptum interventricular mayor de 15mm con disminución de la cavidad ventricular izquierda, no congruente con el otro parámetro .
d) Displasia arritmogénica del ventrículo derecho
Por otra parte, esta enfermedad es una importante causa de muerte súbita en el mundo, sobre todo en Europa, y especialmente en Italia. Existe un estudio del norte de Italia, en donde analizan las causas de muerte súbita en menores de 35 años de 1979 a 1996, y encuentran que la Displasia arritmogénica del ventrículo derecho es la patología más frecuente con el 22.4%, por encima de la Miocardiopatía hipertrófica (2.0%) y las anomalías del origen de las arterias coronarias (12.2%) . En contraparte, en el estudio realizado por Aguilera y cols. en España, encuentra que esta causa de muerte súbita en menores de 35 años, representa solo el 6.8% de los casos revisados de los años 1991 a 1997. En dicho estudio, se encontró una predominancia muy marcada sobre el género masculino (95.2%), con una relación aproximada de 2:1.
La Displasia arritmogénica del ventrículo derecho es una enfermedad del músculo cardíaco de etiología desconocida caracterizada por inestabilidad eléctrica, debido a la presencia de atrofia muscular y remplazo del miocardio ventricular derecho por tejido adiposo o fibroadiposo (56,57). Aunque la etiología es desconocida, se ha encontrado una relación de tipo familiar, por lo que algunas investigaciones han podido identificar un defecto dentro del cromosoma 14q23-q24 (56,57).
Las características anatómicas en estudios autópsicos han observado disminución de los elementos contráctiles de la pared ventricular derecha y su sustitución por tejido adiposo, apareciendo fundamentalmente en el subepicardio del ápex, el infundíbulo y la zona subtricuspídea del mismo ventrículo, formando el llamado "triángulo de la displasia". Se han distinguido dos tipos histopatológicos: la lipomatosa y la fibrolipomatosa, esta última asociada a dilataciones aneurismáticas, cicatrices y adelgazamiento de la pared .
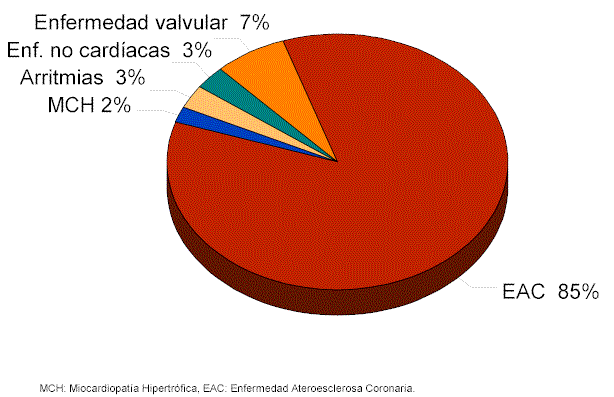
IV. Causas de muerte súbita en mayores de 35 años
Los atletas mayores de 35 años de edad, representan una población diferente en cuanto a las causas de presentación, aunque prácticamente son las mismas etiologías, la incidencia es disímil. En éstos, la enfermedad ateroesclerótica coronaria es con mucho, el principal motivo, observándose con menor porcentaje de presentación otras enfermedades como la miocardiopatía hipertrófica, enfermedad valvular e identificación de arritmias cardíacas (cuadro I). Esta causa representa aproximadamente el 80% de las muertes súbitas durante ejercicio en atletas de la edad antes mencionada (58). Generalmente se les observa, una enfermedad ateroesclerosa grave subyacente (43), es decir, lesiones obstructivas mayores del 75%.
Existen otras causas menos frecuentes de muerte súbita en atletas de este grupo de edad, como son: Prolapso de la válvula mitral , Estenosis aórtica (5,46,60) Miocarditis (45,61), Síndrome de Marfán (62), Síndrome células falciformes (63-66), trastornos del sistema de conducción cardíaca y arritmias (67-77), uso de la cocaína (5,78,79), uso de esteroides (80-84), Sarcoidosis (12,43), Conmoción cardíaca (85-87), enfermedad de Kawasaki (16), accidentes cerebro-vasculares (88,89), golpe por calor (88,90), enfermedades pulmonares incluyendo asma (91,92) y tumores intracardíacos (93).
V. Cuadro clínico
La poca frecuencia de síntomas prodrómicos, hacen que la muerte súbita aparezca como evento inicial, lo que hace más difícil su prevención (15,94). Alrededor de la tercera parte de los pacientes que sufren de muerte súbita, presentan algún tipo de síntomas prodrómicos (95), entre éstos, podemos encontrar: dolor precordial, palpitaciones, mareos, disnea, pre-síncope y síncope (45,96). Este último, es la manifestación en que mayor atención debemos de poner, ya que se relaciona muy estrechamente con muerte súbita .
Las dos categorías principales en que se puede clasificar al síncope son: el reflejo (vasovagal, ortostático, etc) y el cardíaco (mecánico o eléctrico) . Existe un tercer grupo, menos común, en que se contemplan las causas no cardiovasculares e inexplicables. Por otra parte, se calcula que alrededor de 0.16% al 4.7% de corredores de larga distancia, tienen síncope durante la competencia, debido a diversos factores tales como la deshidratación, obesidad, entrenamiento inadecuado, sobreentrenamiento, lesiones previas y la inadecuada aclimatación al momento de la carrera. Hablando de causas cardiovasculares, en la miocardiopatía hipertrófica, uno de sus principales síntomas es el síncope . No cabe duda, que siempre que se presenta este evento es dramático y deberá de evaluarse correctamente y en forma completa, para poder diagnosticar la causa desencadenante y prevenir la muerte súbita.
VI. Prevención
De lo anteriormente expuesto se deduce la necesidad de un examen exhaustivo a cada atleta, además de una meticulosa historia clínica para encontrar posibles factores de riesgo que predispongan la muerte súbita .
La realización de exámenes periódicos y completos a deportistas, para diagnosticar procesos morbosos que los pongan en riesgo a muerte súbita, es la única forma de poder prevenir tal evento. El propósito de estas valoraciones es encontrar sujetos con riesgo para presentar eventos cardiovasculares durante el ejercicio. Se han propuesto diferentes cuestionarios fáciles de realizar entre los grupos participantes de cualquier actividad física, de diferentes edades, aplicado por médicos y personal paramédico encargados de la atención directa de los deportistas, y en los que se pueden identificar cuales presentan riesgo alto y entonces derivarlos a especialistas.
Entre éstos, se encuentran principalmente el PAR Q & YOU, de la Sociedad Canadiense de Fisiología del Ejercicio (101), y la propuesta por la Asociación Americana de Corazón (AHA) y el Colegio Americano de Medicina del Deporte (ACSM) (cuadro III) (102). En dichos cuestionarios, el interrogatorio se enfoca a determinar la presencia de signos y síntomas cardiovasculares, que nos orienten al diagnóstico temprano de enfermedades y factores de riesgo para muerte súbita. Son 13 las preguntas recomendadas por el AHA, enfocadas a encontrar antecedentes de importancia cardiovascular, tales como: dolor de pecho, síncope/presíncope, falta de aire inexplicable, fatiga inexplicable asociada con el ejercicio, detección de soplo cardíaco, incremento de la presión arterial, historia familiar de muerte prematura, enfermedades cardiovasculares en parientes relativamente cercanos menores de 50 años, miocardiopatía hipertrófica, miocardiopatía dilatada, síndrome de QT largo, síndrome de Marfán, arritmias clínicamente importantes (29,103).
Simons (104) en su artículo de Prevención de Muerte Súbita, menciona que la disminución en la incidencia de ésta en atletas jóvenes, se debe a la implementación de la medicina preventiva, tal como lo refiere R. C. Cantu expresidente del Colegio Americano de Medicina del Deporte en Indianápolis.
Sobre la evaluación periódica de los atletas, se ha discutido mucho al respecto y en l996, se publicaron las recomendaciones por parte del AHA (29) y en 1998 un anexo , en donde se especifica que las valoraciones por medio de una historia clínica personal y familiar, así como la exploración física completa y detallada para atletas colegiales, deben realizarse por personal calificado antes de comenzar el entrenamiento y competencias y continuar con revisiones cada año en los siguientes 3-4 años. En los atletas a nivel universitario, cada 2 años deberá de efectuarse la evaluación posterior a la basal. Cuando se obtengan cambios en el estado médico o alguna anormalidad, se tendrá entonces la evidencia para enviar a especialista o solicitar exámenes de apoyo . El electrocardiograma y la radiografía de tórax, siguen siendo elementos muy importantes para valorar de primera intención a los deportistas .
Cuando se detectan anormalidades que pueden poner en riesgo la vida del deportista, nos debemos de apoyar en lo propuesto por el AHA y el ACSM en la 26ª Conferencia de Bethesda, en relación a cada uno de los task force.
Sigue constituyendo un gran dilema para el deportista el aceptar cuando se le niega la participación competitiva en su actividad favorita, pero tenemos que convencerlo de los dictámenes médicos, ya que contamos con la experiencia del basquetbolista Reggie Lewis' que tuvo muerte súbita sobre la duela, cuando previamente ya se le había notificado que debía restringir su actividad física.
Otro gran grupo de personas en las cuales debemos enfocar la prevención, son aquellas que siendo aparentemente sanas, están realizando o van a realizar un programa de acondicionamiento físico para mejora de su peso corporal, como coadyuvante en su apariencia física, o solamente en forma recreativa. Sobre todo, si se tratan de varones mayores de 40 años, o mujeres mayores de 50 años, de acuerdo a la Clase IIb de sujetos asintomáticos y Clase I en estudios pediátricos con factores de riesgo y que van a iniciar un programa de ejercicio . Los riesgos de complicaciones o de muerte súbita son mayores cuando la actividad física es vigorosa; ésto hay que tomarlo en cuenta para poder solicitar la prueba de esfuerzo o algún otro estudio complementario . Nunca hay que olvidar los procesos por los que pasa un sujeto en el momento de la práctica deportiva, que pueden aumentar el riesgo de muerte súbita por un mal entrenamiento, tales como la deshidratación, desequilibrio electrolítico, aumento de la presión arterial, etc. Es por ello que siempre deben de ser apoyados por un entrenador calificado, además de tener una revisión médica, para poder disminuir el riesgo de complicaciones precipitadas por el ejercicio, y aprovechar los beneficios del ejercicio en personas con enfermedad cardíaca en prevención primaria y secundaria . En un estudio realizado en 10,540 atletas, estudiantes en la ciudad de Iowa, encontraron que 20 personas tenían razones cardiovasculares para impedirles el ejercicio físico; además, en 442 sujetos se les restringió su actividad . Ésto demuestra la facilidad de descubrir factores que ponen en riego la vida del deportista durante el ejercicio físico. Los deportistas más jóvenes son más difíciles de convencer que aquellos de edad madura para que disminuyan o suspendan la actividad física, por diversas razones que envuelven al joven .
El tomar una decisión como la antes mencionada, requiere de tener conocimientos amplios de la medicina del deporte, porque involucra aspectos médicos, psicológicos, legales, económicos y sociales, y cada persona o grupo relacionado con el deportista debe de asumir el rol que le corresponde para el cuidado médico integral del atleta . Las contraindicaciones que se pueden tener ante un deportista para que realice ejercicio físico, son muy específicas y atañen directamente a factores que ponen en riesgo su vida, que hablando de aspectos cardiovasculares, las principales son las enfermedades congénitas o la coronaria ateroesclerótica, las cuales, identificándolas, se deben enviar los pacientes a manejo por un especialista. Es muy importante tener en cuenta que las consideraciones que se hagan sobre un atleta en relación con la disminución o cese de la actividad física, son sólo recomendaciones, y deberán de ser valoradas por el propio atleta, su familia, su entrenador, y en su caso, la escuela a la que pertenece, para determinar entonces, que actitud tomar más adelante con el sujeto afectado.
En forma similar a lo que se realiza en otras partes del mundo, por ejemplo en Italia y España, en nuestra institución llevamos a cabo dos tipos de valoración médico deportiva para la autorización de realización de actividad y física y deportes: el primario, en el cual se le realiza historia clínica general basándonos en la exploración física completa y en un cuestionario escrito sobre antecedentes patológicos de importancia principalmente cardiovascular; el secundario, en el cual se aplica una revisión cardiológica especializada, electrocardiograma de reposo y prueba de esfuerzo. En grupos de deportistas de alto rendimiento, se les agrega ecocardiograma a la batería de estudios practicados. Solamente cuando es necesario y de acuerdo a los hallazgos en las revisiones, se les solicita monitoreo electrocardiográfico Holter, prueba de mesa basculada, angiografía coronaria o estudio electrofisiológico. Cuando una persona es inicialmente revisada en forma primaria, y se le encuentran alteraciones sugestivas de cardiopatía, o datos de riesgo para muerte súbita, es enviado a la valoración secundaria.
Un aspecto muy importante es el implementar el equipo médico de apoyo para resucitación cardiopulmonar dentro de la institución deportiva que se trate, para que sepan actuar eficaz y eficientemente en el momento de presentarse un problema médico mayor. Este equipo médico consiste en el personal y el material adecuado y completo para poder suministrar una resucitación oportuna .
VII. Conclusión
La muerte súbita es un fenómeno con baja incidencia de presentación, pero que debemos de poner mucha atención en la prevención de ella, por medio de los exámenes médicos a toda persona con actividad física que presente síntomas, para ir limitando aún más su aparición. Creemos que la utilización de cuestionarios enfocados para la detección de antecedentes y/o síntomas cardiovasculares son fundamentales, para evaluar a grandes grupos de personas, como lo son en escuelas o asociaciones deportivas, en las que es necesario dejar al descubierto posibles factores de riesgo, para después evaluar clínicamente y en forma integral al sujeto que presente probabilidades de sufrir eventos mayores.
Es muy importante, que cuando encontremos alguna alteración en el sujeto, valoremos la necesidad de enviarlo con un especialista para su manejo integral, apoyándonos en las recomendaciones propuestas en la 26ª Conferencia de Bethesda.


SCACEST TRATAMIENTO
Infarto Agudo de Miocardio no Complicado. Manejo Intrahospitalario
Presentación clínica
El Consensus emitido por The Joint European Society of Cardiology/American College of Cardiology Committee for the Redefinition of Myocardial Infarction (European Heart Journal 2000;21), [1] define como posible infarto agudo de miocardio (IAM) al dolor que incluye tórax, epigastrio, brazos, muñeca o maxilar de aparición con el esfuerzo o en reposo. Este dolor generalmente dura al menos 20 minutos, pero puede ser más breve. Puede presentarse en el centro o a la izquierda del tórax e irradiarse a brazos, mandíbula, espalda u hombros. No es usualmente agudo como puntada o altamente localizado, salvo excepciones, y puede estar asociado a disnea por insuficiencia ventricular izquierda, náuseas, vómitos, diaforesis, o síncope. El dolor puede presentarse primariamente en forma atípica en el epigastrio (a menudo confundido con patología digestiva), brazos, hombros, muñeca o espalda sin ocurrir en el tórax. No está afectado por los movimientos de los músculos de la región donde él está localizado, ni es posicional. Estos síntomas pueden estar en asociación con el dolor de pecho o presentarse en ausencia de éste.
En muchos pacientes puede no reconocerse el dolor de pecho y confundirse con un cuadro viral o trastorno digestivo. La necrosis miocárdica puede ser asintomática y manifestarse por marcadores séricos, electrocardiográficos, estudios de imágenes cardíacas u otros. [20]
Se sospecha IAM con elevación del segmento ST cuando el paciente tiene dolor de características isquémicas mayor de 20´ de duración que no cede con nitritos sublinguales en 3-5´, y que puede ser acompañado de otros síntomas tales como sudoración, palidez, náuseas, vómitos, mareos o disnea.
Diagnóstico
1. Electrocardiograma
Cambios ECG indicadores de isquemia miocárdica que puede progresar a IAM: supradesnivel nuevo o presumidamente nuevo del segmento ST igual o mayor de 0,1 mv en dos o más derivaciones contiguas periféricas o igual o mayor de 0,2 mv en derivaciones precordiales, ambos medidos a 0,08 seg del punto J o Bloqueo Completo de Rama Izquierda presumiblemente nuevo.
Cambios electrocardiográficos en el IAM establecido: cualquier QR en V1 a V3 > ó = a 0,03 seg; onda Q anormal en Dl, Dll, aVL, aVF, o V4 a V6; deben estar presentes en dos derivaciones contiguas y ser al menos de 1mm de profundidad.
El ECG brinda información importante para juzgar la localización y extensión del miocardio amenazado. La tabla 15 [18] muestra una clasificación del infarto de miocardio basada en el ECG de presentación correlacionado con la angiografía coronaria, y la tasa de mortalidad que puede esperarse para cada uno de ellos.
Observar derivación a VR para descartar lesión de tronco. [18a].
2. Marcadores séricos
La necrosis miocárdica puede ser reconocida por la aparición en sangre de diferentes proteínas liberadas dentro de la circulación debido al daño de los miocitos; los más importantes son Mioglobina, Troponina T e I y CPK.
El IAM es diagnosticado cuando niveles sanguíneos de marcadores sensibles y específicos, como los mencionados, están elevados como consecuencia de la injuria miocárdica. Estos marcadores reflejan daño miocárdico pero no indican su mecanismo. Por lo tanto, un valor aumentado en ausencia de evidencia clínica de isquemia, debería promover la investigación precoz de otras causas de daño miocárdico, tales como miocarditis.
a) Troponina T: Cada laboratorio debe proveer el rango de los valores normales de referencia. Los valores permanecen aumentados durante 7-10 días ó más después del inicio de la necrosis miocárdica. Existe una demora entre el inicio de aparición de niveles dosables de Troponina T de alrededor de 6 horas.
b) CPK-MB: Cuando la troponina cardíaca no está disponible, la mejor alternativa es la CK-MB, Esta es menos específica que la troponina, aunque los datos sobre su especificidad clínica para detectar injuria miocárdica son más robustas. En caso de disponer de Troponina T cuantitativa se consideraría positivo un valor igual o mayor a 0.1 ng/ml. En la mayoría de los pacientes la muestra de sangre podrá ser obtenida en el momento de admisión, a las 6-9hs y a las 12-24hs. (si las muestras más precoces son negativas y el índice de sospecha de IAM es alto). Dada la transcendencia de la toma de decisión de reperfusión lo más precozmente posible en el infarto agudo de miocardio, el diagnóstico no debe basarse en los marcadores séricos debido a la demora en la positivización de sus valores,(como se refiriera anteriormente de alrededor de 6 hs.)
c) CPK total: Su medición no se recomienda para el diagnóstico de rutina de IAM, debido a la amplia distribución tisular de esta enzima. En caso de necesitar ser utilizada debe ser combinada con troponina o CK-MB para un diagnóstico más certero de IAM.
En los centros de muy baja complejidad (hospitales tipo C), en caso de no disponerse de las anteriores enzimas se deberá recurrir a las menos específicas CPK, GOT, LDH e Isoenzimas de la LDH.
El diagnóstico de certeza de IAM necesita de la presencia de al menos dos de los tres criterios mayores de diagnóstico (sospecha clínica, alteraciones en el ECG y alteraciones enzimáticas). Es trascendente recordar que el diagnóstico de "sospecha de IAM" más alteraciones electrocardiográficas es suficiente para decidir la administración de alguna estrategia de reperfusión.
4. Diagnóstico de reinfarto
Es aquel cuadro clínico que se acompaña de reelevación de la CK-MB, habiendo previamente una disminución de la misma, haya o no angor, como así también de cambios electrocardiográficos con supradesnivel del segmento ST.
5. Diagnóstico diferencial
Deberán considerarse, entre otros, la pericarditis, la disección aórtica , el neumotórax y la úlcera gastroduodenal complicada (ver diagnostico diferencial de dolor precordial).
Conducta inicial en la Sala de Emergencia
Reconocimiento inicial
Es altamente deseable disponer de un ECG de 12 derivaciones dentro de los 10 minutos y completar el examen físico dentro de los 20 minutos posteriores de la presentación.
Evaluación del riesgo al ingreso
Con el objetivo de identificar al paciente como de alto riesgo para la toma de decisiones podemos tener en cuenta el "score" de riesgo TIMI [4b] que se encuentra en la Tabla 16 o el propuesto recientemente por Morrow y col [7a] quien lo evaluó inicialmente en 13000 pacientes con IAM con supradesnivel del ST en el InTime ll y posteriormente lo convalidó en los estudios TIMI 9 A y 9 B, observándose una estrecha relación entre el grupo de riesgo y la mortalidad a las 24 hs, intrahospitalaria y en 30 días. Por lo tanto, se sugiere aplicar este simple score que se obtiene aplicando la siguiente fórmula: (FC.[edad/10]2)/PAS). En el cuadro 2 se observa la relación entre la mortalidad y los distintos grupos de riesgo.
Medidas de rutina (Centros A, B y C)
a) Inserción de una vía periférica.
b) Administración de oxígeno
c) Se sugiere administrarlo a todos los pacientes por 2-3 hs y luego sólo a aquellos con congestión pulmonar y/o saturación de O2 menor del 90%.
d) Monitoreo electrocardiográfico
e) Aliviar el dolor
Administración de nitritos vía sublingual o endovenosa (i.v.) o evaluando la respuesta; en caso de persistir con dolor administrar morfina: en dosis de 4-8 mg, seguida de 2-8 mg i.v. cada 5-15´) Sustituto: Nubaína. Efectos adversos: náuseas y vómitos, (indicar antieméticos), hipotensión y bradicardia (indicar atropina i.v.); depresión respiratoria (contrarrestar con naloxona en dosis de 0,04 mg i.v., máximo 3 dosis con intervalos de 3 minutos).
Traslado a Unidad de Cuidados Intensivos (Centros A y B ). Los centros C deberán procurar trasladar al paciente a un Centro A ó B; mientras lo hacen, deberían asistirlo con las medidas de rutina antes mencionadas y el tratamiento específico del Infarto. En caso de que el traslado a otra Institución se demore más de 90+-30 min, deberán comenzar con el tratamiento fibrinolítico, si están en condiciones básicas para hacerlo.
Conducta Terapéutica en la Unidad de Cuidados Intensivos
A. Tratamiento específico
Antiagregantes plaquetarios
a) Aspirina: Administrar cuanto antes, si no se lo hizo en el departamento de emergencias (o sala de guardia) en dosis de 160-325mg, la primera de ellas masticable o disuelta, y continuar indefinidamente con aspirina diariamente.
Recomendación clase 1, Evidencia A, Centros A-B-C.
b) Clopidogrel (18): En caso de estar absolutamente contraindicada la Aspirina (alergia o UGD activa), o tener manifestaciones gastrointestinales. Dosis: 75mg cada 24 hs precedida de una toma de 4 comp. de 75mg. Recomendación clase 1, Evidencia A, Centros A-B-C
En caso de decidirse reperfusion mecánica se debe administrar dosis de carga de clopidrogel que ha demostrado su eficacia en prevenir, al igual que la ticlopidina la trombosis aguda de stents.
Recomendación clase 1, Evidencia A, Centros A
Reperfusión miocárdica
Todo paciente con sospecha razonable de IAM con supradesnivel del segmento ST o BCRI presumiblemente nuevo (sino se dispone de ECG anterior el BCRI se considerará como nuevo), que ingrese dentro de las 12 hs de haber comenzado los síntomas, debe someterse a reperfusión con fibrinolíticos. Recomendación clase 1, evidencia A, Centros A y B o angioplastia primaria recomendación clase 1, evidencia A, Centros A.
1. Trombolíticos
La reperfusión farmacológica con agentes fibrinolíticos es el método estándar disponible en la gran mayoría de las instituciones en que se tratan la amplia mayoría de pacientes con sospecha de IAM transmural.
a) Recomendaciones [1a,2].
Clase l: Paciente con menos de 12hs de evolución, supradesnivel persistente del ST o BCRI presumiblemente nuevo
Clase lll: Contraindicaciones Absolutas:
* Stroke hemorrágico previo; otros strokes o eventos cerebrovasculares dentro del año.
* Neoplasma intracraneal conocido
* Sangrado interno activo
* Sospecha de Disección Aórtica
* Infección estreptocócica reciente, utilizar rtPA.
Clase llb: Contraindicaciones relativas
* ºHipertensión severa no controlada al ingreso >180/110mmHg
* Historia de ACV previo o patologia intracerebral conocida que no es una contraindicación.
* Uso corriente de anticoagulantes en dosis terapéuticas RIN >/= 2-3.
* Diátesis hemorrágica conocida.
* Punción vascular no compresible
* Sangrado interno reciente (dentro 2-4 s)
* Exposición previa a la STK, especialmente 5 días a 2 años. Antecedente de reacción alérgica.
* Embarazo
* Ulcera péptida activa
* Historia crónica de HA severa.
* Trauma reciente (dentro 2-4 semanas), incluyendo trauma cerebral o traumático o RCP prolongada (>10´) o cirugia mayor (<3s).
(°Si las cifras son menores a 180/110 mmHg luego del tratamiento rápido podrán utilizarse los agentes trombolíticos).
b) Drogas
Estreptoquinasa (SK): Se administra i.v. 1.500.000 UI en 100cc de Dextrosa 5% entre 30-60´
Activador Tisular del Plasminógeno (rt-PA) (Régimen acelerado) (2a): Se administra 15 mg en bolo, seguidos de infusión i.v. en dosis de 0,75 mg/kg en los primeros 30 min., no excediendo de 50 mg, y 35 mg en los 60 minutos restantes
Selección del fibrinolítico:
De acuerdo a las recomendaciones [3a y 4a] se deben categorizar a los pacientes de acuerdo al riesgo clínico y a la probabilidad de sufrir un ACV hemorrágico [3b], en enfermos de alto y bajo riesgo clínico y/o hemorrágico (ver tabla 17). El número de factores de riesgo presentes aumenta la mortalidad . En pacientes que no tienen ninguno de ellos, la mortalidad es de sólo 1,5%; cuando 1 factor está presente es del 2,3%, en caso de que presente 2 de ellos es del 7%, aumentando al 13% y 17,2% respectivamente cuando se hallan presentes 3 y 4 factores de riesgo.
Esta categorización es importante, porque permite tomar decisiones en determinadas situaciones como lo es el seleccionar uno de los dos trombolíticos [5-7]. Lo importante, más allá de puntualizar cuál agente es el más eficaz, es tratar a la mayor cantidad de pacientes con el agente disponible, y hacerlo en el tiempo óptimo.
En el subgrupo de pacientes que tienen menos de 4hs. de evolución, la velocidad de reperfusión del vaso responsable del infarto es de gran importancia; por lo tanto, en este subgrupo de pacientes de alto riesgo clínico y de bajo riesgo para sufrir un ACV hemorrágico, se sugiere el uso de rt-PA. En los pacientes que ingresan luego de 4 a 12hs. desde el inicio de los síntomas, se sugiere la utilización de SK, ya que en este intervalo de tiempo la velocidad de reperfusión del vaso responsable del infarto es de menor importancia (GUSTO I). Un estudio más reciente [23a] sugiere que en pacientes con más de 4hs desde el inicio de los síntomas, de escogerse un agente fibrinoespecífico, el Tecneteplase sería el de elección sobre el rt-PA (eficacia equivalente, menor tasa de sangrado y posibilidad de su utilización en bolo).
Situaciones clínicas
a) Pacientes mayores de 75años [1a]: se debe evaluar la relación riesgo/beneficio, y si el mismo es de alto riesgo clínico deberá decidirse por la administración del trombolítico.
Recomendación lla, Evidencia A
b) Pacientes con una TAS mayor de 180 mmHg o TAD mayor 110mmHg al ingreso (1a): se debe tratar de estabilizar la TA y una vez logrado, si el paciente es de alto riesgo clínico y de bajo riesgo para sufrir un ACV hemorrágico deberá indicarse el trombolítico. Si por el contrario, el paciente presenta varios factores de alto riesgo clínico y alto riesgo para sufrir un stroke hemorrágico, se debe considerar una ATC directa.
Recomendación lla, Evidencia A
c) Pacientes que ingresan con menos de 12hs. con supradesnivel del ST o BCRI aún sin angor: deben ser sometidos a terapias de reperfusión.
d) Pacientes que ingresan con angor con más de 12hs. y menos de 24hs de evolución [11,8]: Se debe indicar el trombolítico si el paciente persiste con síntomas anginosos a pesar de que hayan transcurrido más de 12hs. y más aún si es de alto riesgo clínico.
Recomendación lla, Evidencia A
e) Recurrencia de la angina con reelevación del segmento ST [1a.2]: Evaluar angioplastia (ATC) de rescate si fuera factible, más aún si existe compromiso hemodinámico o si se considera que el IAM es de alto riesgo. Si no fuera factible realizarla en tiempo útil se puede considerar una segunda administración de trombolítico como intento de estabilización definitiva (35% de los casos) o puente para el traslado al laboratorio de hemodinamia.
Recomendación Ila, Evidencia A
f) Ausencia de criterios de reperfusión (no reperfundidos) [1a.2]: (el planteo es similar al anterior si al cabo de los 90' no hay indicios de reperfusión exitosa.
g) Paciente con 2 ó más factores de alto riesgo que ingresa con un IAM no complicado y que tiene contraindicaciones para el uso de trombolíticos [16]: debería ser derivado a un centro de alta complejidad con indicación de ATC directa, si esta fuera posible.
h) Paciente con IAM extenso (anterior o inferolaterodorsal, o con infarto previo) que presenta además otro factor de riesgo, no complicado, con contraindicaciones para el uso de fibrinolíticos: debería ser derivado para ATC directa, si fuera posible.
Recomendación Clase I para centros tipo A. Los Centros B y C deben implementar el traslado.
Complicaciones del tratamiento fibrinolítico
a) Reacciones Alérgicas [1a,2,6]: frecuencia:1,7%. Es más frecuente con la SK, se presenta en los primeros minutos, puede manifestarse como: edema angioneurótico, con rápida aparición de prurito, eritema, edema facial, de manos, pies, y excepcionalmente de glotis. La administración de corticoides no es efectiva en prevenir esta complicación.[8]
b) Hipotensión [8]: La incidencia es del 10%. Se produce durante la infusión y puede ser atribuida a un efecto vasodilatador arterial. La caída de la TAS a menos de 90 mmHg es frecuente, y depende de la velocidad de infusión. Se deberá reducir la velocidad de infusión, administrar solución salina, y colocar al paciente en posición de Trendelenburg
c) Hemorragia [9]: La incidencia de hemorragia aumenta con el uso de STK (ISIS 2) y cuando se asocia heparina, siendo 5,3%, 2,6%, 1,5% para los usos de heparina i.v., heparina s.c. y no uso de heparina, respectivamente. Con agentes fibrinoespecíficos el uso de heparina es mandatario
Conducta a seguir en caso de hemorragia como consecuencia del uso de fibrinolíticos en el IAM [9]
a) Verificar si la hemorragia está localizada en sitios de punción, canalización, trauma, etc., en cuyo caso se debe cohibir la hemorragia por métodos mecánicos.
b) Si la hemorragia es importante, efectuar estudios de coagulación, (aPTT, tiempo de trombina, Quick, recuento de plaquetas, tiempo de sangría, dosaje de fibrinógeno).
c) Si el fibrinógeno está disminuido administrar 10 Unidades de crioprecipitados y verificar los niveles de fibrinógeno. Si continúa siendo menos de 1.0 g/l, infundir 10 unidades de crioprecipitados. Diez unidades incrementan el fibrinógeno plasmático en 0,70 g/l y el Factor Vlll en 40%.
d) Si el tiempo de sangría excede los 9' administrar 10 unidades de plaquetas.
e) Si los valores de fibrinógeno plasmático están bajos, el recuento de plaquetas es normal, el tiempo de sangría menor de 9' y no hay hemorragias en los sitios de punción venosa sino en cavidades cerradas, con aPTT prolongado y PDF elevados, infundir antifibrinolíticos.
El conocimiento previo del estado bioquímico del paciente permitiría corregir otras causas que pudieran haber estado asociadas a la hemorragia.
Hemorragia Cerebral [8]: Varía de acuerdo a las características clínicas del paciente y al trombolítico prescrito. La incidencia de hemorragia cerebral estratificada de acuerdo al número de factores de riesgo que tiene el paciente es de 0,26%, 0,96%, 1,32% ó 2,17% para enfermos sin o con 1, 2 ó 3 factores de riesgo para hemorragia cerebral, respectivamente. La incidencia global es del 0,7%, y se ha incrementado con los nuevos y más potentes agentes fibrinolíticos fibrino-específicos.
Criterios de reperfusión [10]
Se considerará como positivo si a las 2 hs. de comenzada la infusión están presentes:
a) Dolor: la disminución del 50% o más para valores basales de 5/10 en la escala subjetiva de dolor o la desaparición total si los valores iniciales son 4 ó menos.
b) Supradesnivel del ST: la caída de la sumatoria de ST al 50% respecto de la basal.
c) Enzimas: Incremento significativo de la CPK total, mayor al doble del valor basal (del ingreso).
El grupo ECLA (10,12,14) demostró la utilidad de los criterios de reperfusión, observando que los pacientes con una caída de la sumatoria del ST a las dos horas después de los trombolíticos era mayor en los Killip A vs BCD (55vs46%; p<0,05) y lo mismo ocurrió también en los Killip A: siendo mayor la mortalidad en aquellos con criterios negativos (3,4%vs 10,7%; p<0,01)
Falla de trombolisis. Segunda administración de trombolíticos y Angioplastia de Rescate
La trombólisis puede fallar en reperfundir la arteria relacionada al infarto en hasta 50 % de los casos, como fuera dicho. En estos casos el diagnóstico se basa en 3 elementos diagnósticos: a) persistencia de sobreelevación del segmento ST b) persistencia del dolor y c) ausencia de pico enzimático precoz de CPK y CK-MB. La presencia de los 3 signos es muy específica de ausencia de reperfusión pero sólo está presente en 18 % de los casos, por lo cual es poco sensible. Cuando falta alguno de los signos la especificidad también baja.
En otros casos, la isquemia-injuria cede inicialmente pero la arteria se reocluye en 10-15 % de los casos [18-20]. De éstos, 1 de cada 3, vale decir el 4-5 % mostrará clínicamente reinfarto con recurrencia del dolor a las pocas horas y nuevo desnivel de segmento ST. En presencia de isquemia prolongada detectada por la ausencia del síndrome de reperfusión o reaparición de síntomas por reinfarto en general se plantea la necesidad de conocer la anatomía coronaria y actuar en consecuencia. Si la anatomía es favorable se optará en general por la angioplastía de rescate, sobre todo si se trata de un infarto anterior extenso. Un solo estudio de angioplastía de rescate en IAM anteriores extensos mostró mejor evolución con reducción significativa de muerte o insuficiencia cardíaca a 30 días respecto a los pacientes con falla de trombolisis que no fueron tratados [21].
Otra opción, entre tanto, es una segunda administración de fibrinolíticos -rtPA si el primer tratamiento fue SK- . Con esta estrategia la mitad de pacientes se estabiliza y los síntomas y signos ceden, en el 50 % de los casos definitivamente y en la otra mitad temporariamente, permitiendo el traslado al laboratorio de hemodinamia. La retrombolisis no se asoció como se supondría a exceso importante de hemorragias mayores, sobretodo a ACV hemorrágico [22, 23].
En conclusión, el costo-riesgo-beneficio está a favor de la reperfusión. La retrombolisis es segura y puede ser considerada como puente a la ATC de rescate o como terapéutica definitiva cuando se carece de tal posibilidad.[22a,22b]
Conclusión: Qué se debe hacer cuando la reperfusión fue fallida?
Se ha sugerido [21a] seguir un algoritmo con la resolución del segmento ST, la concentración de la Mioglobina [21b] y la persistencia del dolor precordial, como guia para indicar una retrombolisis o angioplastia de rescate, una vez finalizada la reperfusión con trombolíticos cuando la misma pudiera no haber sido exitosa. Nosotros, dado los costos y la escasa disponibilidad en Argentina de mioglobina, sugerimos la utilización de la cpk-MB basándonos, además en los resultados del grupo ECLA [10] y de otros estudios.
Shroeder y col [21c] recientemente publicaron un subestudio del InTIME ll demostrando que el simple análisis del ECG a los 90´ de la trombolisis, con respecto a la disminución del supradesnivel del ST en la derivación con los cambios máximos, es útil y más simple para su cuantificación que la resolución de la sumatoria del ST [21d], para estimar el pronóstico del paciente dentro de los 180 días. Ver cuadro 3.
Por lo tanto, modificando el algoritmo de Braunwald y Lemos [21a], con lo propuesto por Schroeder y adaptándolo a nuestro país [10], sugerimos el flujograma del cuadro 4.
2. Angioplastia directa o primaria
a) Recomendaciones
Clase l y Evidencia A: Si es realizada en un tiempo útil, por hemodinamistas entrenados en el procedimiento y soportado por personal experimentado en un apropiado laboratorio de cateterismo.
Tiempo óptimo: insuflación del balón dentro de los 90´(±30 min) de la admisión.
Hemodinamistas experimentados y en centros con alto volumen de procedimientos.
La angioplastia debería ser método alternativo a la trombolisis (clase 1) si en el centro pueden: a) asegurarse un éxito primario de 90% de flujo TIMI II/III; b) la necesidad de cirugía de emergencia menor de 5%, y c) una tasa de mortalidad ligada al procedimiento menor al 10%.
Clase II b: Más allá de las 12 y menos de 24 hs. desde el inicio de los síntomas si persisten los síntomas isquémicos.
Clase III: (Contraindicación de angioplastia primaria):
a) Realizar una ATC electiva de una arteria no relacionada con el infarto en un paciente cursando un IAM.
b) Más allá de las 12hs del comienzo de los síntomas en pacientes sin evidencias de isquemia de miocardio.
c) En pacientes que han recibido trombolíticos y no presentan síntomas de isquemia miocárdica. d) Pacientes que son elegibles para trombolisis y son sometidos a ATC primaria en un centro que sólo cuenta con un operador sin la necesaria experiencia o en un laboratorio sin respaldo quirúrgico.
En resumen, la angioplastia primaria es el método de elección como estrategia de reperfusión, asociándose a un indice de recanalización de la arteria culpable superior a la terapia farmacológica sobre todo si se usan agentes no fibrinoespecíficos, siempre que se cuente en el centro con resultados conocidos y aceptables y el equipo esté disponible durante las 24 horas y todos los días del año.
Para los pacientes que son tratados en la gran mayoría de los centros, el tratamiento fibrinolítico , sigue siendo el más empleado en el manejo de la reperfusión miocárdica en la fase hiperaguda del IAM por su amplia disponibilidad y ser operador independiente.
El beneficio ligado a la reperfusión de la arteria relacionada al infarto es sumamente tiempo- dependiente. Así, si se consigue la reapertura del vaso ocluido en la primera hora desde el comienzo de los síntomas, la reducción de mortalidad es cercana al 50%, decayendo el beneficio hasta alrededor de 15-20% si han transcurrido 12 horas. Por lo tanto, todo esfuerzo debe realizarse para iniciar la administración del agente trombolítico o realizar una angioplastia directa cuanto antes, luego de admitido el paciente.
Aquellos centros que dispongan de facilidades para administrar tratamiento fibrinolitico deben iniciarlo cuanto antes (Centros A, B y C). No se debe demorar el inicio del tratamiento intentando transferir al paciente a centros de mayor complejidad (Centro A) para realizar una angioplastia directa si ello implica una demora de más de 90 minutos para llevarla a cabo.
Se recomienda fuertemente que los Centros de tipo C que puedan confirmar el diagnóstico del IAM implementen el tratamiento inicial con aspirina, tratamiento antiisquémico y tromboliticos si cuentan con las mínimas facilidades para su instrumentación. Mientras tanto deberán, gestionar la derivación a un centro de mayor complejidad para cursar la fase hiperaguda del IAM en Unidad Coronaria. Los pacientes con alta sospecha clínica de IAM en los que no se pueda confirmar razonablemente el diagnóstico de IAM y tengan alta sospecha clínica deberán administrar aspirina y ser derivados a Centros de Mayor Complejidad.
B. Tratamiento adyuvante a la reperfusión
1. Antitrombínicos indirectos
Heparina [1a]
Pacientes a quienes se les efectúo revascularización miocárdica percutaneo o quirúrgico. Recomendación Clase I.
Heparina no fraccionada: ajustada por peso, por vía i.v. cuando se administra rt-PA como trombolítico. Se comienza antes de administrar el rt- PA (con objeto de contrarrestar el efecto protrombótico del agente fibrinolítico) con un bolo de 60 U/kg (máximo 4.000 U) seguido de infusión i.v. en dosis de 12 U/kg/h con un máximo de 1.000 U/h para pacientes con peso corporal >70 kg,. durante 48hs. Se debe mantener un aPTT entre 50-70'' o 1,5-2 veces el basal. (90'' favorecen el sangrado y no se asocian a beneficio). Para el seguimiento de la anticoagulación ver nomograma sugerido. La continuación de la heparina por más de 48hs, estaría restringido a pacientes de alto riesgo para tromboembolismo sistémico o venoso. Recomendación Clase I
Heparina de Bajo Peso Molecular
Las Heparinas de bajo peso molecular o fraccionadas han sido recientemente estudiadas como terapia adyuvante al tratamiento fibrinolítico. Estos compuestos tienen farmacocinética más predecible, se ligan menos a las proteínas del plasma, se asocian menos a activación plaquetaria y no necesitan ser monitoreadas en su utilización. Por otro lado, su costo es mayor en comparación a las heparinas no fraccionadas.
Varios estudios iniciales de reducidas dimensiones [23b-23e] observando puntos finales subrogados sugieren que el uso de heparinas fraccionadas aumenta los índices de recanalización y de permeabilidad tardía el vaso relacionado al infarto, disminuye la reoclusión y reinfarto y se asocia a mejor perfusión tisular cuando se lo compara con el de heparina no fraccionada como adyuvante del tratamiento fibrinolítico.
Sin embargo, un solo estudio de moderadas dimensiones [23a] observando la incidencia de puntos finales clínicos sugiere que la enoxaparina como coadyuvante al uso de un agente trombolítico fibrinoespecífico -Tecneteplase- se asocia a reducción del end point combinado constituido por muerte a 30 días, reinfarto, isquemia refractaria (endpoint de eficacia) sin incremento de la ocurrencia de ACV hemorrágico pero sí de sangrado total y mayor, en relación a heparina no fraccionada.
En relación a la asociación de heparina de bajo peso molecular asociada a la SK, un estudio [23c] observando la permeabilidad tardía (7-10 días) de la arteria relacionada al infarto y la regresión del desnivel del ST, sugiere ventajas de su utilización respecto a controles. Un trial de grandes dimensiones examina los posibles beneficios y desventajas del uso de enoxaparina vs. control en pacientes con IAM tratados con SK [24a].
Estudios futuros, de mayores dimensiones deberán confirmar que esa y/u otras heparinas fraccionadas son la mejor asociación de antitrombínicos indirectos con agentes fibrinolíticos antes de formular recomendaciones definitivas.
b) Por vía subcutánea heparina no fraccionada en dosis de 7.500 U dos veces por día o heparina de bajo peso molecular ej. Enoxaparina 1mg/kg 2v/d, en todos los pacientes no tratados con trombolíticos que no tengan contraindicación para heparina. En los pacientes de alto riesgo para embolia sistémica, la heparina endovenosa es la preferida para luego continuar con warfarina o acenocumarol vía oral. Recomendación clase lla
c) Por vía intravenosa en pacientes con alto riesgo de embolismo sistémico tratados con trombolíticos no fibrinoespecíficos (SK): La infusión de heparina debe comenzar cuando el aPTT retorne a <2 veces del control (70"), y debe infundirse en dosis necesaria para mantener un aPTT 1,5-2 veces del control (infusión inicial 1.000U/h). Luego de 48hs. de administración se debe considerar el cambio a heparina subcutánea, warfarina, o aspirina sola. Ver Nomograma Tabla 18.
Recomendación clase lla.
En pacientes con alto riesgo de embolismo sistémico no tratados con trombolíticos, se debe hacer un bolo de heparina sódica de 60-70U/Kg (máximo 5000U) v/ev seguido por una infusión de 12-15U/Kg/h (máximo 1000U/h) y debe infundirse en dosis necesaria para mantener un aPTT 1,5-2 veces del control.
Recomendaciones Clase III (contraindicaciones):
Heparina endovenosa de rutina dentro de las 6hs a pacientes recibiendo un fibrinolítico no selectivo (estreptoquinasa) y que no están en alto riesgo para embolismo sistémico.
Alto Riesgo para embolia sistémica:
- IAM Anterior
- Fibrilación auricular
- Embolia previa
- Sospecha de trombo intracavitario
Manejo de la anticoagulacion:
Para la titulacion de la Heparina no fraccionada se utiliza el aPTT. Debido a que cada institución posee un valor determinado del mismo basal o normal, cada centro tiene que fijar su nomograma, de todos modos el manejo de la anticoagulación debe ser del siguiente modo: el control del aPTT debe ser cada 6 hs. y cuando dos consecutivos sean similares y dentro del rango deseado, el próximo será a las 24hs. El valor que se debe fijar es 1,5-2,5 veces el valor normal. Controles extras serán también realizados en caso de que el paciente presente hipotensión, isquemia o sangrado. Para manejar la heparina se sugiere el siguiente nomograma si los controles basales son compatibles con los que hay en la institución.
2. Antitrombínicos directos
Hirudina
La hirudina es un inhibidor directo de la trombina, que inhibe a la trombina circulante y también a la ligada a la fibrina, lo que la hace atractiva en presencia de trombolisis. No necesita unirse a la antitrombina III, la anticoagulación es más constante y necesita de menos controles (aPTT).
En los estudios GUSTO-2B [24] y TIMI-9B [25], comprendiendo 15.141 pacientes con síndromes isquémicos agudos, la hirudina produjo una modesta reducción del punto final combinado muerte o infarto no fue estadísticamente significativo (OR:0,91; IC 95 %; 0,82 a 1,02 p = 0,08).
La producción de trombina y la activación plaquetaria incrementa la actividad protrombínica, la cual pueda promover hasta 300.000 veces la actividad posterior de trombina [27]. La generación de trombina por la terapia trombolítica a su vez genera una situación altamente trombogénica. En apoyo de esta hipótesis, la administración de hirudina en el estudio TIMI 5 demostró que el flujo TIMI grado 3 se lograba en 73 % de los casos a los 90 minutos con la administración de hirudina antes de la administración de rtPA. Estas cifras son muy superiores a las logradas en GUSTO-2B y TIMI 9B.
Hirulog (o bivalirudin)
Es un péptido sintético de 20 aminoácidos que inhibe directamente la trombina libre y también la ligada al trombo; cuando administrado en dosis apropiadas como adyuvante de la trombolisis puede evitar la formación y propagación de trombos y facilitar la lisis de los mismos.
En el estudio HERO-1 [28], comparando hirulog con heparina en pacientes con IAM tratados con SK, se demostró que el flujo TIMI grado 3 a los 90 minutos fue significativamente mayor con hirulog (48 %) que con heparina (35 %). El HERO-2 (29,29ª))comparó la asociación de la STK con la heparina no fraccionada vs. STK y bivalirudin. Se demostró que la bivalirudin no reduce la mortalidad con respecto a la heparina no fraccionada, aunque sí disminuye la tasa de reinfartos dentro de las 96 hs en un 30%.
No existen recomendaciones para su utilización.
3. Anticoagulación oral (warfarina o acenocumarol)
Hay evidencias que sugieren que la warfarina aislada o asociada con aspirina después de un IAM, iniciada en la etapa hospitalaria y antes del alta, reduciría la tasa de reinfarto y de eventos mayores, aunque con una mayor tasa de sangrado (32a y 32b)). Lo anterior provee una base racional para la investigación de un rol de la anticoagulacion oral prolongada luego de la terapia fibrinolítica en pacientes sobrevivientes de un IAM.
Recomendación I, Evidencia A: En pacientes con fibrilación auricular crónica o con trombo intraventricular
Recomendación II a, Evidencia B: En pacientes con áreas extensas de alteración del movimiento de la pared ventricular.
Recomendación III, Evidencia A: No tiene indicación en los IAM no complicados.
Dosificación:
En caso utilización de anticoagulación oral mantener un RIN de 2-3, en presencia de aspirina
4. Inhibidores de los receptores glicoproteicos GP IIb/lIIa plaquetarios
El receptor glicoproteico IIb/IIIa (GP IIb/IIIa) es una molécula adhesiva integrínica y vía final común de la agregación plaquetaria. Al activarse la plaqueta por estímulos que derivan del accidente de placa, el receptor se extruye, sufre cambios conformacionales y se convierte en apto para interacturar con moléculas adhesivas ligantes de la sangre, siendo la principal de ellas el fibrinógeno, que forma puentes entre 2 receptores GP IIb/IIIa de distintas plaquetas constituyendo el esqueleto del nuevo trombo. El receptor GP IIb/IIIa es muy abundante (50.000 a 70.000) por plaqueta, lo que resalta su importancia para constituir con el fibrinógeno la base del trombo blanco.
Como se refiriera anteriormente en Síndromes Coronarios Agudos sin elevación de ST - angina inestable e Infarto de Miocardio sin elevación de ST (IMSEST)- una amplia investigación de los inhibidores del receptor en el escenario de la angioplastía en angina inestable e infarto de miocardio y en el tratamiento clínico de los SCAs sin elevación de ST en la Unidad Coronaria ha probado que esos agentes son de beneficio cuando se administran con aspirina y heparina versus aspirina + heparina.
La magnitud del beneficio es mayor cuando son utilizados en el laboratorio de hemodinamia que cuando lo son en la Unidad Coronaria (ATC de urgencia o electiva en AI e IMSEST y ATC primaria o por isquemia recurrente en el IAMQ. Varios estudios dirigidos a determinar la mejor dosis para obtener los índices más altos de permeabilidad coronaria cuando son administrados como terapia adyuvante de la trombolisis como tratamiento del IAMQ han sido completados TAMI-8 [30], IMPACT-MI [31]; PARADIGM [32]. Ver Tabla 19.
Dos estudios [23a y 32c] examinando los efectos de una infusión de 12hs. de abxicimab con dosis reducida de tecneteplase más heparina ajustada por peso vs. tecneteplase a dosis standard más heparina ajustada por peso corporal, no demostraron reducciones en la ortalidad a 30días ni ACV hemorrágico, pero si de las complicaciones isquémicas del IAM; sin embargo, esto fue a costa de un incremento de sangrado mayor y menor, especialmente en mayores de 75 años y diabéticos. Por lo tanto, el uso de dosis reducidas de fibrinolíticos con abciximab no puede ser recomendado hasta este momento como manejo rutinario de pacientes con IAM.
El abciximab se utiliza en la angioplastia directa en pacientes con lesiones complejas asociadas con trombos o en pacientes de alto riesgo cursando un IAM. Es decisión del cardiólogo invasivo su indicación en el laboratorio de hemodinamia.
C. Tratamiento coadyuvante
1. Nitroglicerina:
No ha sido demostrado en forma convincente un beneficio asociado al uso rutinario de nitratos en la fase inicial del infarto de miocardio [1.2.8]. Su utilización no rutinaria está indicada en infartos transmurales grandes o extensos (IAM anterior) por 24-48hs [8], isquemia persistente, hipertensión o insuficiencia cardíaca. Se puede continuar más allá de las 48hs. en casos de angina recurrente o congestión pulmonar persistente (Clase 1).
Debe administrarse con bomba de infusión intravenosa, 10-20 ug/m aumentando la dosis en 5-10 ug/m cada 5-10', monitorizando cuidadosamente la respuesta clínica y hemodinámica. Se puede titular de acuerdo al control de los síntomas clínicos o hasta la disminución de la TAS del 10% en pacientes normotensos o del 30% en aquellos hipertensos. Deben mantenerse cifras de TAS superior a 100 mmHg y evitarse un aumento de la FC mayor de 10 latidos/m o que exceda los 110 latidos/m. Dosis mayores a 200 ug/m deben ser evitados por el riesgo potencial de inducir hipotensión arterial.
A las 48hs se debe suspender la administración por 14hs. para evitar la tolerancia que se produce al administrar nitratos en forma continuada. En caso de que se produzca taquifilaxis, ésta puede ser superada incrementando la dosis o cambiando a nitratos orales con intervalos libre de droga (1).
Efectos adversos: hipotensión, taquicardia refleja, lo que puede empeorar la isquemia miocárdica, agravación de la hipoxia por aumentar el mismatch ventilación/perfusión; cefaleas. En los infartos de cara inferior con compromiso del VD se debe administrar cuidadosamente, siendo conveniente hacerlo, para mejor seguridad, con monitoreo hemodinámico. Debe tenerse en cuenta la interacción con heparina, ya que inducen disminución de la sensibilidad a la heparina, requiriendo aumentar la dosis de esta última para obtener el nivel de anticoagulación deseada. Puede aumentar el riesgo de hemorragias al suspender la NTG si se continúa con la misma dosificación de heparina.
En caso de que la NTG produzca bradicardia e hipotensión se debe interrumpir la droga, elevar los miembros inferiores y/o administrar Atropina.
Recomendación 1. Evidencia A; Centros A y B.
En los Centros C sólo se recomienda la via oral comenzando precozmente luego de la presentación en pacientes sin contraindicaciones.
2. Beta bloqueantes [1a]
Todo paciente sin contraindicación para el uso de betabloqueantes, en especial aquellos de mediano y alto riesgo clínico, debe recibirlo precozmente por vía intravenosa, seguido de administración oral por tiempo indefinido. Su administración es independiente de la administración de trombolíticos o la realización de angioplastia primaria. En pacientes con disfunción ventricular sin congestión pulmonar se sugiere la utilización del carvedilol [35a]
Recomendación clase 1; Evidencia A y Centros A y B. En los Centros C solamente se recomienda la via oral.
Fármacos y dosis:
a) Atenolol: 5-10 mg i.v.. Administrar 5 mg/m i.v., repetir a los 5-10´ si la FC no es menor a 60 latidos/m y la TAS no inferior a 100mmHg. Administración oral: 25-100mg /d indefinidamente. Otra opción es el esmolol, que es un betabloqueante de acción muy corta que se administra por v/iv (sólo en centros A y B).
b) Propanolol: Comenzar con 10-20mg cada 6-8hs v/iv ó v/o. La titulación será igual que con el anterior.
c) Carvedilol: comenzar con 6,25mg ½-1 comprimido cada 12hs hasta 50mg/d.
Contraindicaciones:
- FC menor de 60 latidos/min
- TAS menor de 100 mmHg
- Insuficiencia cardíaca moderada a severa
- Signos de hipoperfusión periférica
- Intervalo PQ superior a 0,24''
- Enfermedad pulmonar obstructiva crónica (EPOC) severa
- Enfermedad vascular periférica severa (para administración oral)
- Asma bronquial
- Diabetes insulino dependiente (contraindicación relativa).
3. Bloqueantes del Sistema Renina Angiotensina-Aldosterona:
a) Inhibidores de la ECA:
A todos los pacientes se le administrará precozmente luego del diagnóstico de IAM con elevación del ST en ausencia de hipotensión arterial. Una nueva evaluación a las 48hs seleccionará a aquellos con insuficiencia cardíaca clínica o con fracción de eyección ventricular izquierda menor del 40% a los que se les deberá administrar indefinidamente en ausencia de hipotensión significativa (menor de 100mmHg) o de otras contraindicaciones para su uso (alergia, tos). Recomendación clase 1, evidencia A, centros A, B y C.
Se puede utilizar cualquiera de los compuesto que actualmente se comercializan, comenzando con dosis bajas y titulando la dosis diaria hasta lograr la mayor que no induzca a disminución de la TAS a valores inferiores a 100 mmHg.
En infartos no complicados puede iniciarse durante el primer día de internación y valorar su continuación por tiempo indefinido a las 48-72hs. Si no existieran signos de disfunción ventricular izquierda o insuficiencia cardíaca pueden suspenderse.
La evidencia disponible sustenta la intervención precoz en la etapa aguda del IAM. Los resultados del Estudio HOPE(36) (del efecto del Ramipril, un inhibidor de la ECA, administrado contra placebo en 9297pacientes en riesgo de sufrir eventos vasculares luego de haber sufrido un primer evento (IAM, Angina Inestable, Cirugía de Revascularización Coronaria, ATC, etc.) demostró un claro efecto benéfico ligado a la droga. En el seguimiento a 5 años, el Ramipril redujo significativamente la muerte de causas cardiovasculares, infarto, ACV y muerte por cualquier causa. (10,4%vs12,2%; RR=0,84,p=0,005). También redujo la necesidad de revascularización (16,0% vs 18,3% RR=0,85; p=0,002).
b) Bloqueantes de la Angiotensina II:
El uso de los antagonistas de los receptores AT Il deberá aguardar los resultados de los estudios en curso [37].
c) Bloqueantes Selectivo de la Aldosterona:
Ha sido demostrado recientemente los beneficios de la Eplerenone, un bloqueador selectivo de la Aldosterona, en pacientes con disfunción ventricular izquierda después del infarto de miocardio, observándose una disminución de la tasa de mortalidad cardiovascular u hospitalización por eventos cardiovasculares en los pacientes tratados.[37a]
4. Bloqueantes de los canales de calcio [1]:
Las dihidropIridinas estan contraindicadas.
Recomendación Clase lll Evidencia A
Con respecto al Diltiazen y Verapamilo, en el IAM no complicado no están indicados, salvo en aquellos pacientes que tengan indicación de betabloqueantes pero tienen contraindicación clínica para su uso, como lo son los hipertensos, aquellos que cursan con estado hemodinámico hiperquinético y en los pacientes con fibrilación auricular crónica con respuesta ventricular rápida.
Recomendación clase lla para centros A, B y C.
Clase III (Contraindicaciones): Insuficiencia cardíaca, disfunción ventricular izquierda, bloqueo AV.
5. Magnesio
Es empleado para la corrección de déficit de magnesio documentada, especialmente en pacientes recibiendo diuréticos antes del comienzo del infarto.
En episodios de TV y aquellas arritmias asociadas con intervalos QT prolongados deberían ser tratados con 1-2 gr de Mg administrados en bolo i.v. en 5 minutos.
Recomendación Clase lla, Evidencia A para centros A, B y C
6. Solución de Glucosa, Insulina y Potasio
La protección del miocardio isquémico-reperfundido con soluciones de glucosa, insulina y potasio a altas dosis, está siendo estudiada en un ensayo de grandes dimensiones [24a] planificado luego de los resultados de un estudio piloto [41] y un metaanálisis de ensayos previos [42]. Se espera, dadas las dimensiones del trial, que sus resultados respondan definitivamente el interrogante sobre la utilidad de la modulación metabólica en la fase hiperaguda del infarto agudo de miocardio. Sus resultados se esperan para el año 2004.
D. Medidas Generales
1) Control de los signos vitales: Deben registrarse cada 30' hasta la estabilización del paciente; luego cada 4hs. Se debe notificar si la FC es menor de 60 latidos/min. o mayor de 110 latidos/min., la FR menor de 12/min. o mayor de 22/min. y la TAS menor de 90 mmHg ó mayor de 150 mmHg.
2) Electrocardiograma: Diario y todas las veces que presente dolor precordial y/o arritmias.
3) Laboratorio: Enzimas Cardíacas CPK, CPK-MB, GOT y LDH diariamente hasta que se normalicen. Es deseable la determinación de Troponina I ó T por su especificidad para la confirmación del diagnóstico en casos de diagnóticos dudosos. En pacientes con insuficiencia renal crónica la Troponina T puede estar artificialmente elevada.
4) ECO 2-D: A las 72 hs. previo al alta de la Unidad.
5) Rx de tórax: Al ingreso, al día siguiente y posteriormente cada 48 hs.
6) Dieta hipocalórica: En las primeras 24hs es preferible administrar dieta líquida para luego indicar una dieta hipocalórica, normosódica y rica en residuos.
7) Reposo: Se recomienda la movilización precoz en ausencia de complicaciones a partir de las 12hs. La progresión de la actividad es personalizada y dependerá de la edad, estado clínico y de la capacidad física. La deambulación precoz consiste en sentarse en una silla, pararse y caminar alrededor de la cama. Se debe controlar esta actividad con la FC. Si ésta aumenta más del 10% o hay aparición de fatiga o de arritmias se debe suspender la movilización.
Recomendación Clase lla para centros A, B y C
8) Rehabilitación: Es conveniente el acompañamiento por kinesiólogos para la reglamentación de la rehabilitación precoz.
Recomendación lla, Evidencia C.
9) Ansiolíticos: Indicados de acuerdo a la necesidad.
10) Manejo de los lípidos: Se recomienda administrar una dieta con bajo contenido de grasas saturadas y colesterol (menos del 7% de las calorías totales y menos de 200 mg/dl de colesterol) en todos los pacientes durante la recuperación del IAM (43,44)
Recomendación Clase I
Objetivos del perfil lipídico en el paciente post IAM:
- CT <160mg/dL
- LDL <100mg/dL
- HDL >45mg/dL
- Triglicéridos <200mg/dL
E. Traslado a habitación de planta
De acuerdo a la evolución del paciente durante su internación en la Unidad de Cuidados Intensivos deberá categorizárselos nuevamente como de alto y bajo riesgo. Siendo este protocolo para pacientes con IAM no complicado, aquellos de bajo riesgo, deberían transferirse a la habitación a partir de las 48hs. En este caso, el alta puede ser considerada dentro de los 3 a 5 días.
F. Identificación del riesgo
1. Bajo riesgo:
Pacientes sin Infarto previo y que no experimentaron:
- Angor persistente o recurrente
- Insuficiencia Cardíaca
- Bloqueo Cardíaco
- Arritmias ventriculares con deterioro hemodinámico
- Nuevo o aumento del Soplo de Insuficiencia Mitral o CIV
- Fracción d e eyección ventricular izquierda menor del 40%
2. Alto riesgo:
Pacientes que presentan:
- Insuficiencia mitral o CIV
- Angor persistente o precoz o a los mínimos esfuerzos, poniendo de manifiesto isquemia recurrente.
- Insuficiencia cardíaca
- Fracción de eyección ventricular izquierda menor del 40%
- TV / FV sostenida después de luego de las primeras 48 hs.
- Hipotensión
G. Evaluación no invasiva:
1. Prueba de esfuerzo (Ergometría). Recomendación Clase I
- Antes del alta para evaluación pronóstica o capacidad funcional (submáximo a los 4-8 días limitada por síntomas en 10 -14 días).
- Precoz después del alta para evaluación pronóstica y capacidad funcional (14 - 21días)
- Tardía, luego del alta (3 - 6 semanas) para capacidad funcional y pronóstico si la prueba de
esfuerzo precoz fue submáxima.
2. Ecocardiograma stress, Radiocardiograma con ejercicio o Talio con ejercicio o dipiridamol
- Cuando el ECG basal tiene anormalidades que impiden su interpretación Recomendación Clase I
- Cuando el paciente es incapaz de realizar ejercicio. Recomendación Clase ll A
- Para evaluación pronóstica. Recomendación Clase ll A
Contraindicaciones para la realización de Tests de Esfuerzo. Recomendación Clase III
- Test de estrés dentro de los primeros 2-3 días del IAM.
- Test farmacológico o con ejercicio en cualquier momento para evaluar Angina post infarto de miocardio.
- En cualquier momento para evaluar pacientes con IAM con insuficiencia cardíaca descompensada, arritmias cardíacas, o condiciones no cardíacas que limitan severamente su capacidad para el ejercicio.
- Antes del alta para evaluar a pacientes que ya han sido seleccionados para CCG. (En esta situación, un test del ejercicio puede ser útil después del CCG para evaluar la función o identificar isquemia en el área de distribución de una lesión coronaria de severidad dudosa o difícil de evaluar).

Evaluación de arritmias ventriculares. Tests de rutina:
No hay indicación. Recomendación Clase III.
Evaluación Invasiva en el IAM no complicado y no tratados con trombolíticos: CCG y posible revascularización:
Está indicada cuando se demuestra isquemia silente (ECG y monitoreo electrocardiografico) o sintomática, espontánea o inducida con estrés. Recomendación clase l, Evidencia B
No está indicada en forma rutinaria en pacientes con infartos no complicados en ausencia de isquemia comprobada. Recomendación Clase ll b
No está indicada en pacientes con IAM no candidatos para revascularización miocárdica.
Recomendación Clase lll
Angiografía coronaria rutinaria y eventual revascularización después de un tratamiento trombolítico: No está indicado en forma rutinaria cuando no exista evidencia de isquemia espontanea o inducida
Recomendación: Clase llb; Evidencia A
Uso de rutina de ATC de la arteria relacionada al infarto inmediatamente después del tratamiento trombolítico:
No existe indicación de angioplastia rutinaria de la arteria relacionada al infarto dentro de las 48hs. de recibir un trombolítico en pacientes asintomáticos y sin evidencias de isquemia miocárdica. Recomendación Clase IIb, Evidencia A
Suscribirse a:
Entradas (Atom)